
| A. | 船舶防腐时,船体上加装的阳极锌需定期更换 | |
| B. | 合成氨反应中使用高效催化剂可提高原料转化率 | |
| C. | 将图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深 | |
| D. | 等体积、等浓度NaOH溶液和CH3COOH溶液混合后溶液pH=7 |
分析 A、在电解池中,阴极被保护,阳极被腐蚀;
B、催化剂不能使平衡移动;
C、改变影响平衡的一个条件,平衡向能够减弱这种改变的方向移动;
D、等体积、等浓度NaOH溶液和CH3COOH溶液混合后所得的溶液为醋酸钠溶液.
解答 解:A、在电解池中,阴极被保护,阳极被腐蚀,故可以将船体做电解池的阴极,锌做电解池的阳极,故锌需要定期更换,故A正确;
B、催化剂不能使平衡移动,故使用高效的催化剂平衡不移动,则原料的转化率不能改变,故B错误;
C、将图中的活塞快速推至A处,则气体的浓度瞬间增大,故颜色瞬间变深,但由于增大压强后平衡2NO2?N2O4右移,故颜色又逐渐变浅,但由于平衡的移动只能减弱改变,故颜色变浅后还是比原来的深,故C正确;
D、等体积、等浓度NaOH溶液和CH3COOH溶液混合后所得的溶液为醋酸钠溶液,醋酸钠是强碱弱酸盐,水解显碱性,故pH>7,故D错误.
故选AC.
点评 本题综合考查了电化学腐蚀的防护、平衡的移动和盐类的水解等问题,难度不大,应注意的是催化剂不能改变物质的转化率.


科目:高中化学 来源: 题型:多选题
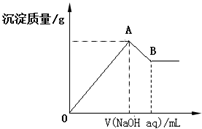
| A. | x=$\frac{3a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值不随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2、FeCl3 | B. | NaHCO3、Na2CO3 | C. | NaAlO2、AlCl3 | D. | Mg(HCO3)2、MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
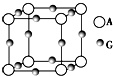 已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.
已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素.其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外价电子数与B相同,其余各层均充满.B、E两元素组成化合物B2E的晶体为离子晶体.C、F的原子均有三个能层,C原子的第一至第四电离能(KJ•mol-1)分别为578、1 817、2 745、11 575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②⑤⑥ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
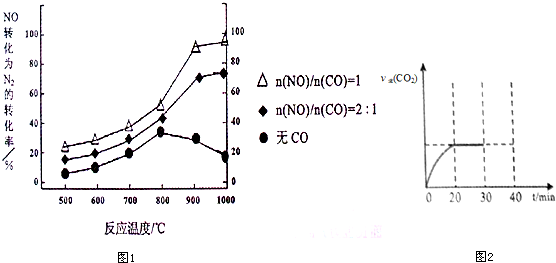
| 浓度/mol?L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
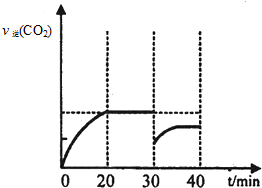 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中金属共失去电子0.1 mol | |
| B. | 合金中,铜的质量为2.8 g | |
| C. | 原硝酸的浓度:c(HNO3)=4.5 mol•L-1 | |
| D. | 要使溶液中的金属离子完全沉淀,需加5 mol•L-1的NaOH溶液60 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com