
����Ŀ��ij��ѧʵ��С�齫װ��ͭ��Ũ������ƿ����һ��ʱ���ȡ����ƿ�й��壬̽����ɷ֡������Ͽ�֪��Ũ������ͭ��Ӧ��������CuS��Cu2S�����Ƕ�������ˮ��������ϡ���ᡣʵ�����£�
��i��������ˮϴ�ӹ��壬�õ���ɫ��Һ������ʺ�ɫ��
��ii��ȡ������ɫ�������Թ��У���������ϡ���ᣬ��ɫ�������ܽ⣬��Һ��Ϊ��ɫ��������ɫ���ݡ�ȡ�����ϲ���Һ���Թܣ��μ��Ȼ�����Һ��������ɫ������
�ٸ���ʵ�飨i���õ���ɫ��Һ��֪�������к�____________���ѧʽ��
�ڸ���ʵ�飨ii��������_______����������������������ȷ����ɫ������CuS����Cu2S��������__________________________________________________________________________��
д��Cu2S��ϡ���ᷴӦ�Ļ�ѧ����ʽ____________________________________________
��Ϊ�˽�һ��̽����ɫ����ijɷ֣���ʵ�飨i���к�ɫ����ϴ�ӡ���ɣ��ٳ�ȡ48.0g��ɫ�����������ʵ�飬ͨ������O2��ʹӲ�ʲ������к�ɫ�����ַ�Ӧ���۲쵽Fƿ��Ʒ����Һ��ɫ��

ʵ����� | ��Ӧǰ��ɫ��������/g | ��ַ�Ӧ���ɫ��������/g |
I | 48.0 | 48.0 |
�� | 48.0 | 44.0 |
�� | 48.0 | 40.0 |
�����ϱ�ʵ�������Ʋ⣺ʵ��I�к�ɫ����Ļ�ѧʽΪ_____________________________��ʵ�����к�ɫ����ijɷּ�����Ϊ_______________________________________________��
���𰸡�CuSO4 ���� CuS��Cu2S�����ᷴӦ�IJ�����ͬ 3Cu2S+16HNO3+=3CuSO4+10NO��+3Cu(NO3)2+8H2O Cu2S Cu2S 24.0g��CuS 24.0g
��������
ϡ�������ǿ�����ԣ��ܰ�S��-2������Ϊ-6�ۣ���Cu��-1������Ϊ+2�ۣ������ᱻ��ԭΪNO��һ��ɫ���壬�ɴ˿���д��CuS��Cu2S��ϡ����ķ�Ӧ����ʽ��������У���Ϊ�漰�������ı仯��������Ҫ���Ƿ�Ӧǰ�������ʵ���Է��������ı仯���������������1��Cu2S����2��CuO��Cuԭ���غ㣩������Է�������û�з����仯����1��CuS����1��CuO��Cuԭ���غ㣩����Է���������С��16�����ò����������ƶϳ�������гɷּ���Ӧ��������
��������ˮϴ�ӹ��壬�õ���ɫ��Һ���������һ������CuSO4��
��CuS��Cu2S��ϡ���ᷴӦ�ķ���ʽ�ֱ�Ϊ��![]() ��
��![]() ��������Ӧ������ɫ��Һ����ɫ�������ɣ��Ҽ���BaCl2��Һ���а�ɫ�������ɣ��������жϺ�ɫ����ijɷ֣�
��������Ӧ������ɫ��Һ����ɫ�������ɣ��Ҽ���BaCl2��Һ���а�ɫ�������ɣ��������жϺ�ɫ����ijɷ֣�
��Fƿ��Ʒ����Һ��ɫ��˵����SO2���ɣ�����ͭԭ�Ӹ����غ㣬��
Cu2S-2CuO ��m=64��2+32-64��2-16��2=0��CuS-CuO ��m=64+32-64-16=16��
ʵ��I�У���Ӧǰ������������䣬��˵����ɫ������ֻ��Cu2S��
ʵ��II�У����������仯��Ϊ4.0g��������ƶϳ��������仯��CuS������
CuS-CuO ��m=16
96 �� �� 16
m(CuS) �� 4.0g
m(CuS)=![]() =24.0g
=24.0g
m(Cu2S)=48.0g-24.0g=24.0g
��ú�ɫ�����Ϊ24.0g��Cu2S��24.0g��CuS��


 ������״Ԫ��ҵϵ�д�
������״Ԫ��ҵϵ�д� ��ʱ�ƿ�������ϰϵ�д�
��ʱ�ƿ�������ϰϵ�д� һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(Ni)���仯����㷺Ӧ����������ء���ƺʹ���������
��1��ij���ط�ӦΪ2NiO(OH)+Cd+2H2O![]() Cd(OH)2+2Ni(OH)2�������س��ʱ����������������__(�ѧʽ)���ŵ�ʱ������73gCd(OH)2�������·��ת�Ƶĵ�������___��
Cd(OH)2+2Ni(OH)2�������س��ʱ����������������__(�ѧʽ)���ŵ�ʱ������73gCd(OH)2�������·��ת�Ƶĵ�������___��
��2�������ʻ���ӦΪ��Ni(s)+4CO(g)![]() Ni(CO)4(g) ��H��
Ni(CO)4(g) ��H��
��һ���¶��£���һ�����Ĵ�����CO���뵽1L�ĺ����ܱ������з�Ӧ��5s����Ni(CO)4�����ʵ���Ϊ1.5mol����0~5s��ƽ����Ӧ����v(CO)=__mol��L��s-1��
�ڸ÷�Ӧ��ƽ�ⳣ��K���¶����߶���С����÷�Ӧ����H__0(����>������<")��
��3��NiSO4��6H2O������һ����ɫ������ˮ�ľ��壬�㷺Ӧ���ڻ�ѧ������������صȣ����ɵ�Ʒ���(�������⣬������Cu��Zn��Fe��Ԫ��)Ϊԭ����ȡ����ȡ�������£�
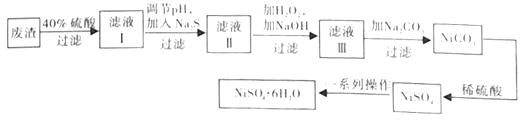
����ʵ�����У�����98%��Ũ����(�ܶ�1.84g��mL-1)����40%��ϡ���ᣬ��Ҫ�IJ����������������⣬����__��
������Һ���м���Na2S��Ŀ����_��(��֪��Ksp[FeS]=6.3��10-18��Ksp[CuS]=1.3��10-36��Ksp[ZnS]=1.3��10-24��Ksp[NiS]=1.1��10-21)
����Һ������������������Ҫ��__��
��NiSO4��ǿ����Һ����NaClO���������Ƶü������ӵ�ص缫����NiOOH���÷�Ӧ�����ӷ���ʽΪ__��
�����Ʊ�NiSO4��6H2O����ʱ��������ˮ�Ҵ���������ˮ��ϴ�Ӽ���ԭ����__(д��һ������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪԭ���װ��ʾ��ͼ��
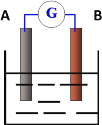
(1)��AΪͭƬ��BΪ��Ƭ�������ΪFeCl3��Һ������ͭƬΪ________�� (������)��д���缫��Ӧʽ������____________����_________________��
(2)��AΪZn��BΪCu���������ҺΪϡ���ᣬ��A�缫����Ϊ _________��д�������ĵ缫��Ӧʽ___________��
(3)���õ�������缫��������Ϊ60g������һ��ʱ���ȡ��пƬ��ͭƬϴ���������أ�������Ϊ47g���Լ��������״�����������Ϊ����L��(��д���������)___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ײʱ����ȫ�����з�����Ӧ��10NaN3+2KNO3��K2O+5Na2O+16N2��������������Ȼ�ԭ�����1.75mol���������жϲ���ȷ����
A. ����44.8L N2����״����
B. ��0.25 mol KNO3����ԭ
C. ת�Ƶ��ӵ����ʵ���Ϊ1.75mol
D. ��������Nԭ�ӵ����ʵ���Ϊ3.75mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷��Ǻ���һ�����ᾧˮ�������������ڹ�ũҵ�����о�����Ҫ����;��ij��ѧ��ȤС����̷���һЩ���ʽ���̽�����ش��������⣺
��1�����Թ��м��������̷���Ʒ����ˮ�ܽ⣬�μ�KSCN��Һ����Һ��ɫ�����Ա仯�������Թ���ͨ���������Һ��졣�ɴ˿�֪��______________��_______________��
��2��Ϊ�ⶨ�̷��нᾧˮ��������ʯӢ�����ܣ����˿���K1��K2������Ϊװ��A�����أ���Ϊm1 g������Ʒװ��ʯӢ�������У��ٴν�װ��A���أ���Ϊ m2 g������ͼ���Ӻ�װ�ý���ʵ�顣

������B��������____________________��
�ڽ�����ʵ�����������ȷ����___________________�����ţ����ظ������������裬ֱ��A���أ���Ϊm3 g��
a.��ȼ�ƾ��ƣ����� b.Ϩ��ƾ��� c.�ر�K1��K2
d.��K1��K2������ͨ��N2 e.����A f.��ȴ������
�۸���ʵ���¼�������̷���ѧʽ�нᾧˮ��Ŀx=________________����ʽ��ʾ������ʵ��ʱ��a��d�����������ʹx__________���ƫ��ƫС������Ӱ�족����
��3��Ϊ̽�����������ķֽ�������2�����Ѻ��ص�װ��A������ͼ��ʾ��װ���У���K1��K2������ͨ��N2�����ȡ�ʵ���Ӧ���в�������Ϊ��ɫ��ĩ��

��C��D�е���Һ����Ϊ_________�����ţ���C��D��������ð�������ɹ۲쵽������ֱ�Ϊ_______________��
a��Ʒ�� b��NaOH c��BaCl2 d��Ba(NO3)2 e��ŨH2SO4
��д�������������·ֽⷴӦ�Ļ�ѧ����ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������CO2����ͨ��NaOH��Ca(OH)2��NaAlO2�Ļ����Һ�У������ɳ��������ʵ�����ͨ��CO2������Ĺ�ϵ�ɱ�ʾΪ(�� )
A.  B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������г���һ������NO2��������Ӧ2NO2��g��![]() N2O4��g����H=��57 kJmol��1���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���ǣ�������
N2O4��g����H=��57 kJmol��1���¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ���ǣ�������
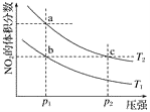
A. a��c����ķ�Ӧ���ʣ�a��cB. a��b�����ת���ʣ�a��b
C. a��c�����������ɫ��a�cdzD. ��a�㵽b�㣬�����ü��ȵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�������л�����![]() ��Ҫ��I2��IO3-����ʽ����
��Ҫ��I2��IO3-����ʽ����![]() ��ˮ�Ʊ����ʵ��ʵ���������£�
��ˮ�Ʊ����ʵ��ʵ���������£�

��֪����.����۵�Ϊ113�棬����̬�ĵ���Բ������ۻ�ֱ��������
��.�ֵ��к������������������ʡ�
����˵����ȷ���ǣ� ��
A.�������з�����Ӧ�����ӷ���ʽΪIO3-+3SO32-=I-+3SO42-
B.�����ٺ͢��е��л���ӷ�Һ©���϶˵���
C.����������
D.�����ݿ�����ͼ��ʾ��ˮԡװ�ý���

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л����������ȷ���ǣ� ��
A.2������3����Ȳ��![]()
B.3���һ���1����ϩ��![]()
C.2������2��4������ϩ��![]()
D.2��2��3���������飺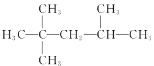
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com