
| 项目 | 空气污染指数 | 空气质量级别 | 空气质量 |
| 可吸入颗粒物 | 65 | Ⅱ | 良 |
| 二氧化硫 | 6 | ||
| 二氧化氮 | 20 |
| A. | 用氢气作燃料 | B. | 露天焚烧垃圾 | ||
| C. | 大量排放汽车尾气 | D. | 用煤作燃料 |
科目:高中化学 来源: 题型:选择题
| A. | 做焰色反应实验用的铂丝要用受热容易挥发的稀盐酸洗涤 | |
| B. | 观察K2SO4的焰色应透过蓝色的钴玻璃 | |
| C. | 可以用焰色反应来区别NaCl溶液和KCl溶液 | |
| D. | 焰色反应一定是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 肯定有一种元素被氧化,另一种元素被还原 | |
| C. | 非金属单质在反应中只做氧化剂 | |
| D. | 某元素从化合物变为单质时,该元素一定被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
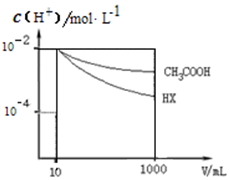 25℃时,三种酸的电离平衡常数如表:
25℃时,三种酸的电离平衡常数如表:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0、△S<0 | B. | △H>0、△S>0 | C. | △H<0、△S<0 | D. | △H<0、△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定 次数 | 待测溶液的体积(mL) | 0.100 0mol•L-1NaOH的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积(mL) | ||
| 第一次 | 20.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 20.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 20.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com