
【题目】软性隐形眼镜可由聚甲基丙烯酸羟乙酯制成超薄镜片,其中聚甲基丙烯酸羟乙酯的合成路线如图所示:

已知:
 +HCN→
+HCN→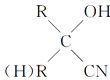
![]()
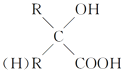
试回答下列问题:
(1)A、E的结构简式分别为A__________,E______________。
(2)写出下列反应的反应类型:A→B_____________,E→F____________。
(3)写出下列反应的化学方程式:
I→G__________________________________;
C→D___________________________________。
【答案】CH2=CHCH3 (CH3)2C(OH)COOH 加成反应 消去反应 CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl 2CH3CH(OH)CH3+O2
CH2OHCH2OH+2NaCl 2CH3CH(OH)CH3+O2![]() 2CH3COCH3+2H2O
2CH3COCH3+2H2O
【解析】
CH2=CH2与Cl2发生加成反应得到I(CH2Cl-CH2Cl),CH2Cl-CH2Cl在NaOH的水溶液中发生取代反应得到G(HOCH2CH2OH);根据聚甲基丙烯酸羟乙酯的结构简式逆推其单体H的结构简式为CH2=C(CH3)COOCH2CH2OH,G与F在浓硫酸存在、加热条件下反应生成H,则F的结构简式为CH2=C(CH3)COOH;A与HBr反应得到B(C3H7Br),C3H7Br与NaOH的水溶液发生取代反应得到C(C3H7OH),C催化氧化得到D,D在HCN和H2O、H+ 作用下反应得到E,E在浓硫酸作用下加热发生反应得到F,结合题给已知和F的结构简式分析,A为CH3CH=CH2,B为CH3CHBrCH3,C为CH3CH(OH)CH3,D为CH3COCH3,E为(CH3)2C(OH)COOH,据此分析解答问题。
CH2=CH2与Cl2发生加成反应得到I(CH2Cl-CH2Cl),CH2Cl-CH2Cl在NaOH的水溶液中发生取代反应得到G(HOCH2CH2OH);根据聚甲基丙烯酸羟乙酯的结构简式逆推其单体H的结构简式为CH2=C(CH3)COOCH2CH2OH,G与F在浓硫酸存在、加热条件下反应生成H,则F的结构简式为CH2=C(CH3)COOH;A与HBr反应得到B(C3H7Br),C3H7Br与NaOH的水溶液发生取代反应得到C(C3H7OH),C催化氧化得到D,D在HCN和H2O、H+ 作用下反应得到E,E在浓硫酸作用下加热发生反应得到F,结合题给已知和F的结构简式分析,A为CH3CH=CH2,B为CH3CHBrCH3,C为CH3CH(OH)CH3,D为CH3COCH3,E为(CH3)2C(OH)COOH,
(1)由上述分析可知,A的结构简式为CH2=CHCH3,E的结构简式为(CH3)2C(OH)COOH,故答案为:CH2=CHCH3;(CH3)2C(OH)COOH;
(2)根据上述分析,A(CH2=CHCH3)与HBr发生加成反应得到B,E在浓硫酸作用下加热发生消去反应得到F(![]() ),故答案为:加成反应;消去反应;
),故答案为:加成反应;消去反应;
(3)I(CH2Cl-CH2Cl)在NaOH的水溶液中发生取代反应得到G(HOCH2CH2OH),I→G的化学方程式为CH2ClCH2Cl+2NaOH![]() HOCH2CH2OH+2NaCl;C与氧气发生催化氧化得到D(CH3COCH3),C→D的化学方程式为2CH3CH(OH)CH3+O2
HOCH2CH2OH+2NaCl;C与氧气发生催化氧化得到D(CH3COCH3),C→D的化学方程式为2CH3CH(OH)CH3+O2![]() 2CH3COCH3+2H2O,故答案为:CH2ClCH2Cl+2NaOH
2CH3COCH3+2H2O,故答案为:CH2ClCH2Cl+2NaOH![]() CH2OHCH2OH+2NaCl;2CH3CH(OH)CH3+O2
CH2OHCH2OH+2NaCl;2CH3CH(OH)CH3+O2![]() 2CH3COCH3+2H2O。
2CH3COCH3+2H2O。


 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子一定能在指定溶液中大量共存的是
A. 能使pH试纸显蓝色的溶液中:Na+、ClO-、Fe3+、SO42-
B. 含有大量Al3+的溶液中:K+、Mg2+、NO3-、HCO3-
C. ![]() =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D. 常温下由水电离出的c(H+)=10-13 mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某探究性学习小组设计如图所示装置分别进行如下探究实验,请回答下列问题:
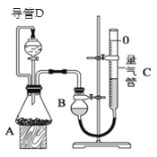
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | Na OH固体、浓氨水 | NH3 | |
Ⅲ | 镁铝合金、足量NaOH溶液 | H2 | H2O |
(1)实验I通过收集并测量NO气体的体积来探究铜样品的纯度,有的同学认为该实验设计不可行,主要原因是__________________________;
(2)实验Ⅱ中量气管中的液体最好是_______(填字母编号,下同)
A.NaOH溶液B.氨水C.煤油D.氯化铵溶液
实验剩余的NH3需吸收处理,以下各种尾气吸收装置中,不能防止倒吸的是________;
(3)①写出实验Ⅲ中涉及的离子反应方程式_________________________;
②反应前,先对量气管进行第一次读数。读数时,应注意的操作是________________,并使视线与凹液面最低处相平;反应后,待装置温度冷却到室温时,再对量气管进行第二次读数。
③实验Ⅲ在25℃、1.01×105Pa条件下获得以下数据:
编号 | 镁铝合金质量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 376.6mL |
② | 1.0g | 10.0mL | 364.7mL |
③ | 1.0g | 10.0mL | 377.0mL |
根据上述数据,计算出镁铝合金中铝的质量分数为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语的表述正确的是
A.惰性电极电解氯化镁溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.钢铁吸氧腐蚀中的正极反应:4OH-- 4e-=2H2O+O2 ↑
C.用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
D.等体积、等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图涉及的物质所含元素中,除一种元素外,其余均为1~18号元素。
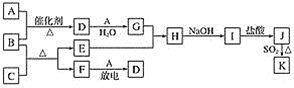
已知:A、F为无色气体单质,B为具有刺激性气味的气体,化学家哈伯因合成B获得1918年的诺贝尔化学奖。C为黑色氧化物,E为紫红色金属单质,I为蓝色沉淀(部分反应的产物未列出)。请回答下列问题:
(1)常温下铝遇到G的浓溶液后表面形成一层致密的保护膜,该现象称为___________。
(2)E与G的稀溶液反应的离子方程式为_________。
(3)在25 ℃和101 kPa的条件下,将VL的B气体溶于100 mL水中,得到密度为ρg·mL-1的溶液M,则M溶液的物质的量浓度为________ mol·L-1。(已知25 ℃、101 kPa条件下气体摩尔体积为24.5 L·mol-1,不必化简)
(4)分别蘸取B的浓溶液和G的浓溶液的玻璃棒,接近后的现象是_________。
(5)B和C反应的化学方程式为__________。
(6)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 相同温度下,同时向 ①4 mL 0.1 molL-1 KMnO4酸性溶液和②4 mL 0.2 molL-1 KMnO4酸性溶液中,分别加入4 mL 1 molL-1 H2C2O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
B | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰,煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
C | 加热2NO2(g) | 颜色加深 | 证明正反应是放热反应 |
D | 分别测定室温下等物质的量浓度的Na2SO3与Na2CO3溶液的pH | 后者较大 | 证明非金属性 S>C |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
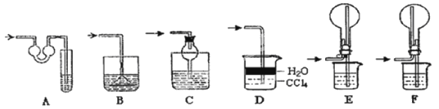
【题目】如图Ⅰ~Ⅳ所示,下列有关说法正确的是( )
A.实验Ⅰ可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体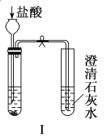
B.实验Ⅱ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠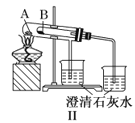
C.与实验Ⅲ相比,实验Ⅱ的优点是可以用一套装置同时进行两个对比实验,而Ⅲ不行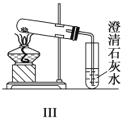
D.实验Ⅳ分别测定等浓度碳酸钠和碳酸氢钠溶液的pH,碳酸氢钠溶液pH大于碳酸钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气与氧气生成水的反应是氢能源应用的重要途径。下列有关说法正确的是
A. 一定温度下,反应2H2(g)+O2(g) ![]() 2H2O(g)能自发进行,该反应的ΔH<0
2H2O(g)能自发进行,该反应的ΔH<0
B. 氢氧燃料电池的负极反应为O2+2H2O+4e![]() 4OH
4OH
C. 常温常压下,氢氧燃料电池放电过程中消耗11.2 L H2,转移电子的数目为6.02×1023
D. 反应2H2(g)+O2(g) ![]() 2H2O(g)的ΔH可通过下式估算:
2H2O(g)的ΔH可通过下式估算:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com