
氮是地球上极为丰富的元素。
(1)已知NCl3+3H2O==NH3+3HClO,该反应无化合价变化,则电负性N___________Cl。
(2)NH3能与众多过渡元素离子形成配合物,例如往CoCl3溶液中加入氨气,可以得到六配位的配合物CoCl3·x NH3,已知1mol的该配合物与足量AgNO3反应,得到2mol AgCl沉淀,则配合物的化学式为____________________________。
(3)NF3的结构与NH3类似,但是NF3难以与过渡金属形成配位键,其原因在于___________________________________________________________________________。
 (4)N2H4分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。N2H4分子中氮原子轨道的杂化类型是___________。
(4)N2H4分子可视为NH3分子中的一个氢原子被-NH2取代形成的另一种氮的氢化物。N2H4分子中氮原子轨道的杂化类型是___________。
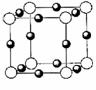
(5)N3-为叠氮根,与CO2为等电子体,1mol N3-中含有_______个π键。X3+电子层结构与氩元素相同,它与N3-形成的晶体结构如图。
晶体的化学式是________________,与同一个X3+相邻最近的N3-有____________个。
科目:高中化学 来源: 题型:
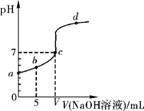
在25℃下,向10.00mL0.01mol·L-1某一元酸HA溶液中逐滴加入0.01mol.L-1NaOH溶液,溶液pH变化曲线如下图所示。下列说法正确的是
A.HA是强酸
B.b点表示的溶液中:c(HA) = c(A-)
C.c点时:V=10.00mL
D.b、c、d三点表示的溶液中一定都存在:
c(Na+)+c(H+) = c(A-)+c(OH-)
1
查看答案和解析>>
科目:高中化学 来源: 题型:
四种短周期元素在周期表中的位置如图,其中只有M为金属元素。下列说法正确的是
A.原子半径Z > Y
B.X 的最简单气态氢化物的热稳定性比Z的小
C.Y的最高价氧化物对应水化物的酸性比X 的弱
D.M的最高价氧化物对应水化物不能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项的叙述中都包含两个数值,前一数值大于后一数值的是
A.HCl中H—Cl键的极性和HF中H—F的极性
B.乙烯CH2=CH2中碳碳σ键的键能和碳碳π键的键能
C.1mol金刚石晶体中C-C键数目和1mol SiO2晶体Si—O键数目
D.MgCl2晶体的熔点与AlCl3晶体的熔点
查看答案和解析>>
科目:高中化学 来源: 题型:
氮化硼(BN)晶体有多种相结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂,但不能导电。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法,正确的是
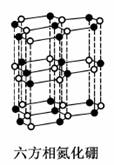
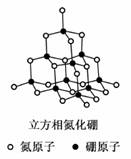
A.立方相氮化硼含配位键B→N
B.六方相氮化硼层间作用力小,所以质地软,熔点低
C.两种氮化硼都属于原子晶体
D.六方相氮化硼晶体其结构与石墨相似却不导电,原因是没有可以自由移动的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
“绿色化学”是指从技术、经济上设计可行的化学反应,尽可能减少对环境的负作用。下列化学反应,不符合绿色化学概念的是 ( )
A.消除硫酸厂尾气排放:SO2+2NH3+H2O==(NH4)2SO3
B.消除制硝酸工业尾气的氮氧化物污染:NO2+NO+2NaOH==2NaNO2+H2O
C.制CuSO4:2Cu+O2==2CuO,CuO+H2SO4==CuSO4+H2O
D.制Cu(NO3)2:Cu+4HNO3(浓)== Cu(NO3)2+2NO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中不正确的是( )
①水分子的电子式为H+ 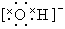 ②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
②离子半径由小到大的顺序是:Mg2+<Na+<Cl-<S2-
③氮分子的电子式为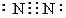 ④只含有离子键的化合物才是离子化合物
④只含有离子键的化合物才是离子化合物
A.①② B.③④ C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
将镁带投入盛放在敞口容器的盐酸里,产生H2的速率与时间
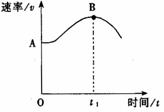 的关系可由右图表示。
的关系可由右图表示。
(1)写出离子反应方程式
(2)在下列因素中①H+的浓度 ②镁带的表面积 ③溶液的温度
④Cl-的浓度 能影响该反应速率的因素有__________(填序号);
(3)解释图中AB段形成的原因 ;
(4)解释图中t1时刻后速率变小的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中不正确的是( )
A.“氯碱工业”通过电解饱和食盐水生产氯气和烧碱。
B.通常状况下,干燥的氯气能和Fe反应
C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状;光照H2和Cl2的混合气体时,因迅速化合而爆炸
D.新制氯水具有漂白性,久置氯水最终变为稀盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com