
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
| n(X) | n(Y) | n(M) | |||
| ① | 700 | 0.40 | 0.10 | 0.090 | |
| ② | 800 | 0.10 | 0.40 | 0.080 | |
| ③ | 800 | 0.20 | 0.30 | a | |
| ④ | 900 | 0.10 | 0.15 | b | |
| A. | 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol•L-1•min-1 | |
| B. | 实验②中,该反应的平衡常数K=2.0 | |
| C. | 实验③中,达到平衡时,X的转化率为60% | |
| D. | 实验④中,达到平衡时,b>0.060 |
分析 A.根据v=$\frac{△c}{△t}$计算v(M),再利用速率之比等于化学计量数之比计算v(N);
B.由表中数据,计算平衡时其它组分的物质的量,由于反应中气体的化学计量数相等,可以用物质的量代替浓度代入平衡常数表达式K=$\frac{c(M)•c(N)}{c(X)•c(Y)}$计算;
C.温度不变平衡常数不变,用a表示出平衡时各组分物质的量,再根据平衡常数列方程计算解答;
D.实验①、②若温度相同,X、Y按1:1反应,二者物质的量相互交换,平衡时生成物物质的量相等,实验②中温度较高,平衡时M的物质的量减小,说明升高温度平衡逆向移动,则正反应为放热反应,若④的温度为800℃,恒容体系中,气体体积不变的反应,实验④与③为等效平衡,平衡时b=$\frac{1}{2}$a=0.06,但④的实际温度为900℃,相比较800℃,平衡逆向移动,则b<$\frac{1}{2}$a.
解答 解:A.速率之比等于化学计量数之比,则v(N)=v(M)=$\frac{\frac{0.05mol}{10L}}{5min}$=1.0×10-3mol/(L•min),故A错误;
B. X(g)+Y(g)?M(g)+N(g)
起始(mol):0.1 0.4 0 0
转化(mol):0.08 0.08 0.08 0.08
平衡(mol):0.02 0.32 0.08 0.08
由于反应中气体的化学计量数相等,可以用物质的量代替浓度计算平衡常数,故实验②中,该反应的平衡常数K=$\frac{c(M)•c(N)}{c(X)•c(Y)}$=$\frac{0.08×0.08}{0.02×0.32}$=1,故B错误;
C. 温度不变平衡常数不变,平衡时M为amol,则:
X(g)+Y(g)?M(g)+N(g)
起始(mol):0.2 0.3 0 0
转化(mol):a a a a
平衡(mol):0.2-a 0.3-a a a
则K=$\frac{a×a}{(0.2-a)×(0.3-a)}$=1,解得:a=0.12,实验③中,X的转化率=$\frac{0.12mol}{0.2mol}$×100%=60%,故C正确;
D.实验①、②若温度相同,X、Y按1:1反应,二者物质的量相互结合,平衡时生成物物质的量相等,实验②中温度较高,平衡时M的物质的量减小,说明升高温度平衡逆向移动,则正反应为放热反应,若④的温度为800℃,恒容体系中,气体体积不变的反应,实验④与③为等效平衡,平衡时b=$\frac{1}{2}$a=0.06mol,但④的实际温度为900℃,相比较800℃,平衡逆向移动,则b<0.06,故D错误;
故选C.
点评 本题考查化学平衡计算,题目难度中等,涉及化学反应速率、化学平衡常数、化学平衡的影响因素等知识,D选项为易错点,注意利用等效思想解答,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 加入少量CuSO4溶液 | B. | 加入少量K2SO4溶液 | ||
| C. | 加入少量的Na2CO3溶液 | D. | 将稀硫酸换为浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀硫酸的反应 | |
| B. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 | |
| C. | 甲烷在氧气中的燃烧 | |
| D. | 白磷自燃 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 反应达到平衡后,其他条件不变,只改变压强,平衡不移动 | |
| B. | 上述反应过程中的平均相对分子质量增大 | |
| C. | 单位时间内反应物浓度的减少等于生成物浓度的增加 | |
| D. | 若在前10s内B减少了xmol,则在前20s内A减少小于2xmol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
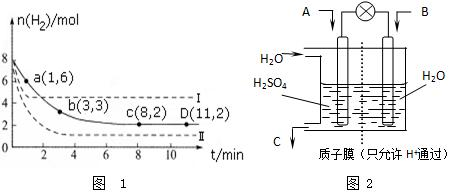
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
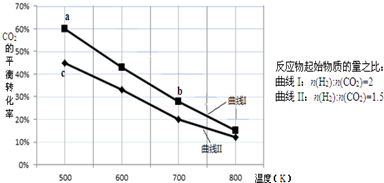
| A. | 该反应的△H>0 | B. | 达平衡时,3v(H2)正=v(CO2)逆 | ||
| C. | a点对应的H2的平衡转化率为90% | D. | b点对应的平衡常数K值大于c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容量 | 甲 | 乙 | 丙 | 丁 |
| A | 2mol | 1mol | 2mol | 1mol |
| B | 1mol | 1mol | 2mol | 2mol |
| A. | A的转化率:丁>丙>乙>甲 | B. | A的转化率:丁>乙>丙>甲 | ||
| C. | B的转化率:丙>甲>乙>丁 | D. | B的转化率:甲>乙>丙>丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 温度(°C) | 起始浓度(mol•L-1) | 平衡浓度(mol•L-1) | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| ① | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| ② | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| ③ | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
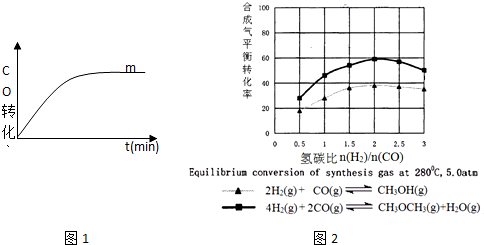
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.2 g CO | B. | 6.6 g CO2 | C. | 8 g SO2 | D. | 9.8 g H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com