
【题目】下列说法正确的是( )
A. 植物油氢化过程中发生了加成反应
B. 淀粉和纤维素互为同分异构体
C. 氨基酸既能与强酸反应也能与强碱反应,但蛋白质不行。
D. 分离沸点相差30℃以上的两种有机物通常使用重结晶的方法
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.原子最外层电子数比次外层电子数多的元素一定位于第二周期
B.从氟到碘,单质与氢气发生化合反应越来越难
C.14 C和14N两种核素的质量数相同,中子数也相同
D.离子化合物中可能含有共价键,但共价化合物中一定不含离子健
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S203)是环保部门监测有害气体常用的一种药品,硫代硫酸钠在生产过程中常混入少量的亚硫酸钠(Na2S03)。某化学课外活动小组利用如图所示装置来测定硫代硫酸钠样品中亚硫酸钠的含量。

(1)写出硫代硫酸钠与稀硫酸反应的化学方程式:________。
(2)组装仪器前,甲同学用装置B、C检验产生的气体,则装置C中可盛有_____(填序号)。A.酸性KMnO4溶液 B. CaCl2溶液 C.品红溶液 D.浓硫酸
(3)乙同学称取m1g硫代硫酸钠样品进行实验。
①E管的作用是____________。
②为了较准确地测得实验结果,装置A、C中应分别盛有_______和_________。
③装置B中滴入过量稀H2SO4且充分反应后,需关闭活塞b,打开活塞a,缓缓通入空气一段时间,其目的是___________,若反应后未通入空气,则测定结果将______(填“偏大”“偏小”或“无法确定”)。
④若实验前后装置C的质量分别为m2g、m3g ,装置D的质量分别为m4g 、m5g ,则样品中Na2SO3的质量分数(设为a)的计算式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G是原子序数依次增大的前四周期元素,A的某种原子无中子,B的最外层有3个成单电子,C与A可形成1:1和1:2的化合物且常温下呈液体,D的原子半径是短周期中最大的,F的最高价氧化物对应水化物是最强的含氧酸,C和E形成的氧化物有两性,G的最高能层符号为N, 且其内层的d轨道电子数与最外层电子数相等。

(1)G原子的价电子排布式为_____________。
(2)BA3的VSEPR模型为_____________。
(3)离子半径C2->D+,原因是_____________。
(4)E与F形成的化合物EF3 在178℃时升华,其蒸气的相对分子质量约为267,蒸气分子的结构式为_____________(标明配位键),其中该蒸气分子中E原子的杂化方式为_________。
(5)A、B、C三种元素可形成盐,则在形成的盐中存在的作用力有_____________。
(6)图甲是G单质的堆积方式,该堆积方式为__________堆积;GC2·H2O可通过CF4水解来制备,则该制备过程的化学方程式为_____________。
(7)A、D、E可形成化合物DEA4 ,在DEA4晶体中,与D+紧邻且等距的EA4-有_____个;DEA4晶体的密度为_____________g/cm3(用含a的代数式表示)。若DEA4晶胞上下底心处的D+被Li+取代,得到的晶体为__________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活密切相关。下列有关说法正确的是
A. 用菜籽油浸泡辣椒涉及萃取知识 B. 玻璃容器可以长期盛放各种酸
C. 用氨做制冷剂是因为氨极易溶于水 D. 不锈钢的防腐原理与电化学有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大。在如图所示的物质转化关系中,p、q、m、n分别是元素W、X、Y、Z的气体单质,p和s均为有色气体,v的水溶液呈碱性。常温下,0.1 molL-1 t溶液与0.1 molL-1 u溶液的pH 均为1。下列说法不正确的是
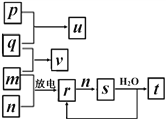
A. Y、W的最高价氧化物对应的水化物均为强酸
B. 元素的非金属性:Z>Y>X,原子半径:X<Z<Y
C. s溶于水的反应中,氧化剂与还原剂的物质的量之比为1:2
D. v的电子式可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是:
A. 碳酸钙溶于稀盐酸中:C032-+2H+=H2O+CO2↑
B. 氢氧化钠溶液中通入过量二氧化碳气体:2OH-+C02=C032-
C. 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag
D. 硫酸钠溶液与氯化钡溶液反应:SO42一+Ba2+=BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/L的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示。 ,下列分析不正确的是
,下列分析不正确的是

A. ROH为弱碱
B. 若a=8,从A到B的过程中,水的电离程度逐渐减小
C. A点溶液c ( Cl-)=c (R+)
D. 若b=15,溶液中存在![]() c(Cl-)+c(ROH)+c(OH-)=c(H+)
c(Cl-)+c(ROH)+c(OH-)=c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com