
【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8
【答案】D
【解析】
A.根据反应速率常数公式可知,化学反应速率不仅与反应物的浓度有关,还和反应物的化学计量数有关,所以从题目中的方程式中可知,反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度不同,故A错误;
B.实验②、④,Br、BrO3浓度不同,无法探究c(BrO3-)对反应速率的影响,故B错误;
C.实验②H+浓度为③的2倍,其他条件都相同,速率②是③的4倍,所以c=2,故C错误;
D.实验②中,Br的浓度是实验①的2倍,速率也是实验①的2倍,由此可得a=1,实验⑤中H+的浓度是④中H+浓度的![]() ,实验⑤中Br浓度是实验④中Br浓度的4倍,则速率④=⑤,故D正确。
,实验⑤中Br浓度是实验④中Br浓度的4倍,则速率④=⑤,故D正确。
故选D。


科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关计算正确的是
A.现有CO、CO2、O3三种气体,分别都含有1molO,则三种气体的物质的量之比为3∶2∶1
B.ngCl2中有m个Cl原子,则阿伏加德罗常数NA的数值可表示为![]()
C.标准状况下,11.2LX气体分子的质量为16g,则X气体的摩尔质量是32
D.4℃时,若20滴水恰好为1 mL,那么1滴水中所含的水分子数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是一门以实验为基础的学科。下列实验装置和方案能达到相应目的是( )
A. 图装置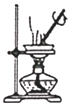 ,加热蒸发碘水提取碘
,加热蒸发碘水提取碘
B. 图装置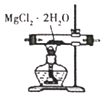 ,加热分解制得无水Mg
,加热分解制得无水Mg
C. 图装置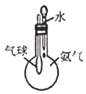 ,验证氨气极易溶于水
,验证氨气极易溶于水
D. 图装置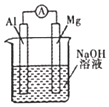 ,比较镁、铝的金属性强弱
,比较镁、铝的金属性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2==4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,单位都为mol/(Ls),则正确的关系是
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2NO2![]() 2NO+O2在密闭容器中反应,达到平衡状态的标志是
2NO+O2在密闭容器中反应,达到平衡状态的标志是
①单位时间内生成nmolO2的同时生成2nmolNO2
②单位时间内生成nmolO2的同时生成2nmolNO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A.①③④B.②③C.①④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填 “晶体”或“非晶体”),可通过__________方法鉴别。
(2)基态Ni2+的核外电子排布式为__________;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO__________FeO(填“<”或“>”)。
Ⅱ、判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示
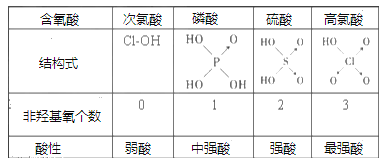
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3只有弱酸性。由此可推出亚磷酸的结构式为___________。从分子结构角度,简述二者酸性强弱原因_____________________。
(2)亚磷酸与过量的氢氧化钠溶液反应的化学方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
(1)基态Fe3+第M层的电子排布式为_______________________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为___________________(用元素符号表示),苯酚中碳原子的杂化轨道类型为____________。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为___________________(用元素符号表示),苯酚中碳原子的杂化轨道类型为____________。
(3)FeSO4常作补铁剂,SO42-的立体构型是_______________。
(4)羰基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等。1molFe(CO)5分子中含_______molσ键,与CO互为等电子体的离子是________(填化学式,写一种)。
(5)氮化铁晶体的晶胞结构如图1所示。该晶体中铁、氮的微粒个数之比为________。
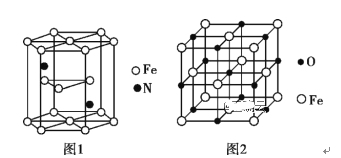
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_________;Fe2+与O2-的最短核间距为_____________ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
是一种重要的化工原料,可用于合成可降解的高聚物C以及抗肿瘤药物G。
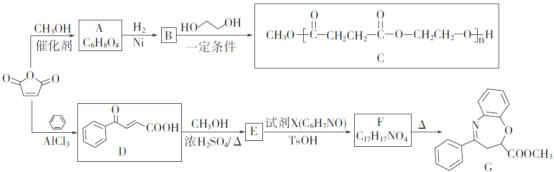
已知: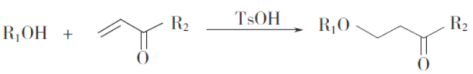
(1)A含有的官能团名称是______________。
(2)D→E的反应类型是_____________________。
(3)E的分子式是____________;F的结构简式是_________________。
(4)B→C的化学方程式为________________________________________。
(5)W是B的同分异构体,0.5mol W与足量碳酸氢钠溶液反应生成44g CO2,W共有______种(不考虑立体异构),其中核磁共振氢谱为三组峰的结构简式为___________。
(6)设计由甲苯和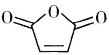 为原料制备化合物
为原料制备化合物![]() 的合成路线(无机试剂任选)______。
的合成路线(无机试剂任选)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O,其相对分子质量为990)简称“三盐”,不溶于水及有机溶剂。以铅泥(PbSO4、PbO、Pb及其他杂质等)为原料制备三盐的工艺流程如下图所示
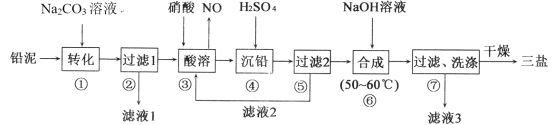
已知:KSP(PbSO4)=1.82×10-8,KSP(PbCO3)=1.46×10-13请回答下列问题:
(1)写出步骤①“转化”的主要离子方程式_______。
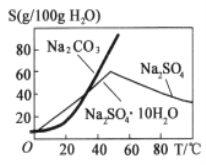
(2)根据图溶解度曲线,由滤液I得到Na2SO4固体的操作为:将“滤液1”________、______、用乙醇洗涤后干燥。
(3)步骤③“酸溶”,为提高酸溶速率,可采取的措施是____________(任意写出一条)
(4)“滤液2”中可循环利用的溶质为___(填化学式)。若步骤④“沉铅”后的滤液中c(Pb2+)=1.82×10-5 mol·L-1,则此时c(SO42-)=____mol·L-1。
(5)步骤⑥“合成”三盐的化学方程式为___________。
(6)若消耗100 t铅泥,最终得到纯净干燥的三盐49.5 t,假设铅泥中的铅元素有75.0%转化为三盐,则铅泥中铅元素的质量分数为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com