
分析 根据反应速率v=$\frac{△c}{△t}$计算得二氧化硫反反应速率,再利用速率之比等于计量数之比求得氧气的反应速率,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),则这段时间内氧气反应掉的浓度为0.5mol/(L•min)×2min=1mol/L,根据方程式可知反应掉的二氧化硫的浓度为2mol/L,据此可求得2min时SO2的浓度,在恒温、恒容容器中,反应前压强之比等于总浓度之比,据此计算.
解答 解:2min内SO2的浓度由6mol/L下降为2mol/L,二氧化硫的反应速率为:v(SO2)=$\frac{6mol/L-2mol/L}{2min}$=2mol/(L•min),所以用O2浓度变化来表示的反应速率为:v(O2)=$\frac{1}{2}$v(SO2)=1mol/(L•min),2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L•min),则这段时间内氧气反应掉的浓度为0.5mol/(L•min)×2min=1mol/L,根据方程式可知反应掉的二氧化硫的浓度为2mol/L,所以2min时SO2的浓度为4mol/L-2mol/L=2mol/L,生成SO3的浓度为2mol/L,所以达平衡时与反应前压强之比为$\frac{1mol/L+2mol/L+2mol/L}{4mol/L+2mol/L}$=5:6,
故答案为:1mol/(L•min);2mol/L;5:6.
点评 本题考查了化学反应速率的计算以及化学反应速率与计量数的关系,计算时一定要注意:已知的物理量与求知的物理量是否是同一物质的,如果不是同一物质的物理量,要转化为同一物质的.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间 (s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/10-4mol/L | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/10-3mol/L | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
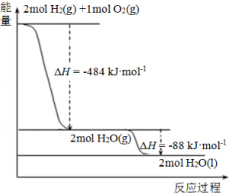
| A. | 926 kJ•mol-1 | B. | 485kJ•mol-1 | C. | 463 kJ•mol-1 | D. | 221 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
| B | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com