
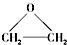
 ),该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$\stackrel{加热}{→}$
),该反应的原子利用率为100%,反应的化学方程式为2CH2=CH2+O2$\stackrel{加热}{→}$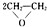 .
. 分析 (1)烃是指仅含碳和氢两种元素的有机物;
(2)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成乙醛;
(3)鉴别乙酸乙酯和乙酸,利用它们的化学性质进行鉴别;
(4)有双键或叁键(不饱和键)的物质中.两个或多个分子互相作用,生成一个加成产物的反应称为加成反应;
(5)根据化学反应符合“绿色化学”思想,原子利用率100%,利用已知的反应物和生成物,即可写出方程式.
解答 解:(1)碳氢化合物属于烃,故答案为:烃;
(2)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成乙醛,反应的化学方程式为2C2H5OH+O2$→_{△}^{铜或银}$2CH3CHO+2H2O,故答案为:2C2H5OH+O2$→_{△}^{铜或银}$2CH3CHO+2H2O;
(3)乙酸具有酸性,它能和碳酸钠反应放出二氧化碳气体,而乙酸乙酯不能,故答案为:水;碳酸钠;
(4)乙烯在催化剂存在条件下与水反应生成乙醇,发生的是加成反应,故答案为:加成反应;
(5)乙烯能被氧气氧化生成环氧乙烷,根据质量守恒定律该反应为:2CH2=CH2+O2$\stackrel{加热}{→}$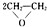 ,故答案为:2CH2=CH2+O2$\stackrel{加热}{→}$
,故答案为:2CH2=CH2+O2$\stackrel{加热}{→}$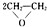 .
.
点评 本题考查有机物的性质,抓住物质的官能团,尤其注意典型有机物和常见官能团的性质,是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
| A | B |
| ①能使含溴的四氯化碳溶液褪色; ②比例模型为: 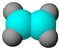 ③能与水在一定条件下反应 | ①由C、H两种元素组成; ②球棍模型为:  |
 .
. +HO-NO2$→_{50-60℃}^{浓硫酸}$
+HO-NO2$→_{50-60℃}^{浓硫酸}$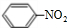 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9-10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )| A. | 可用石墨作阴极,铁作阳极 | |
| B. | a为直流电源的负极 | |
| C. | 除去CN-的反应:2CN-+5ClO-+2H+═N2↑+2CO2↑+5Cl-+H2O | |
| D. | 阳极的电极反应式为:Cl-+2OH--2e-═ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有金属离子 | B. | 共价化合物不可能含离子键 | ||
| C. | 离子化合物可能含共价键 | D. | CaCl2含有离子键,不含共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉水解的最终产物为酒精 | B. | 纤维素水解的最终产物为麦芽糖 | ||
| C. | 油脂水解的产物之一为甘油 | D. | 蛋白质与浓硫酸作用呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
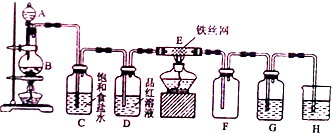
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E五种物质中均含有硅元素,它们能发生如图所示的化学变化,回答:(已知硅与铝相似也能和氢氧化钠溶液反应生成盐与氢气)
A、B、C、D、E五种物质中均含有硅元素,它们能发生如图所示的化学变化,回答:(已知硅与铝相似也能和氢氧化钠溶液反应生成盐与氢气)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 凡需加热的反应一定是吸热反应 | B. | 只有分解反应才是吸热反应 | ||
| C. | 吸热反应一定不能自发进行 | D. | 盐类的水解反应是吸热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com