
 .
.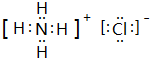 ,A2C2的电子式为
,A2C2的电子式为 .
.分析 A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,则A为H元素;A、D同主族,可形成离子化合物X,故D为Na,二者形成的离子化合物X为NaH;B的单质是空气中含量最高的物质,则B为N元素;C原子的最外层电子是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D、E、F 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强碱、强酸的反应,故E为Al,3种原子最外层共有11个电子,则F原子最外层电子数为11-1-3=7,故F为Cl;B的氢化物与F的氢化物反应生成离子化合物Y为NH4Cl,据此解答.
解答 解:A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大,则A为H元素;A、D同主族,原子序数相差大于2,故D为Na,二者形成的离子化合物X为NaH;B的单质是空气中含量最高的物质,则B为N元素;C原子的最外层电子是次外层电子数的3倍,原子只能有2个电子层,最外层电子数为6,故C为O元素;D、E、F 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,应是氢氧化铝与强碱、强酸的反应,故E为Al,3种原子最外层共有11个电子,则F原子最外层电子数为11-1-3=7,故F为Cl;B的氢化物与F的氢化物反应生成离子化合物Y为NH4Cl.
(1)F元素的名称是:氯,B单质为N2,
故答案为:氮;N2;
(2)用电子式表示化合物NaH的形成过程为: ,
,
故答案为: ;
;
(3)化合物Y为NH4Cl,电子式为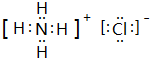 ,H2O2的电子式为
,H2O2的电子式为 ;
;
故答案为: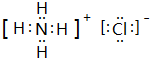 ;
; ;
;
(4)D、F最高价氧化物的水化物分别为NaOH、HClO4,二者反应生成高氯酸钠与水,反应离子方程式为:OH-+H+=H2O;
故答案为:OH-+H+=H2O;
(5)D、E最高价氧化物的水化物分别为NaOH、Al(OH)3,二者反应生成偏铝酸钠与水,反应离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,
故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查位置结构性质关系应用,题目难度中等,推断元素是解题关键,侧重对化学用语的考查,注意理解掌握用电子式表示化学键或物质的形成.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用蓝绿藻等低等生物和微生物在阳光作用下使水分解产生氢气,该方法符合绿色化学原则 | |
| B. | 12C、13C和14C互为同位素,它们的放射性可用于考古断代,可测定生物体死亡的年代 | |
| C. | 食品脱氧剂(含铁粉、氯化钠、炭粉等)的脱氧原理与钢铁的吸氧腐蚀相同 | |
| D. | 利用生物方法脱除生活污水中的氮和磷,防止水体富营养化 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年浙江省高一上第一次质检化学卷(解析版) 题型:选择题
下列化学反应中,属于氧化还原反应的是
A.NaOH+HCl=NaCl+H2O B.NH3+HCl=NH4Cl
C.2FeC12+Cl2=2FeC13 D.H2CO3=H2O+CO2
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未知浓度酸液用滴定管量取,滴定管用蒸馏水洗涤后,没用待测酸液润洗 | |
| B. | 装待测液的锥形瓶用蒸馏水洗涤后,没用待测液冲洗 | |
| C. | 量取酸液的体积时,开始仰视凹液面,取液结束时俯视凹液面 | |
| D. | 滴定开始滴定管尖端有气泡,到达终点时尖端无气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有4种不同的伸展方向 | B. | 有5种不同能量的电子 | ||
| C. | 有5种不同的运动范围 | D. | 有14种不同运动状态的电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增加FeS2的量 | B. | 增大O2的浓度 | C. | 升高温度 | D. | 减小压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6,-2 | +7,-1 | -2 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com