
已知:4NH3(g)+5O2(g)===4NO(g)+6H2O(g);ΔH=-1 025 kJ/mol,该反应是一个
可逆反应。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
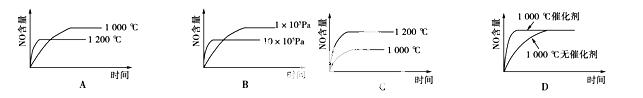
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
铁及其化合物与生产、生活关系密切.
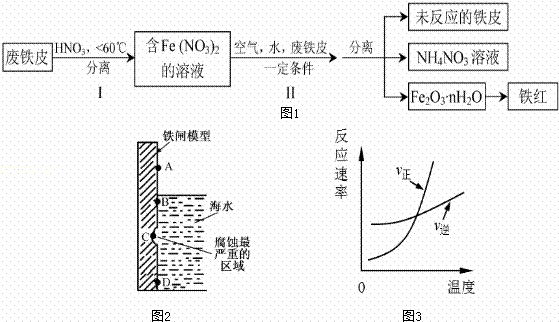
(1)如图2是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图这一腐蚀过程中发生还原反应的物质是 (填化学式).图2中A、B、C、D四个区域,生成铁锈最多的是 (填字母).
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:(图1)
步骤 I若温度过高,将不利于反应的进行,用适当的文字和化学方程式进行解释: .
步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O→2Fe2O3?nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 上述生产流程中,能体现“绿色化学”思想的是 (任写一项).
(3)已知t℃时,反应FeO(s)+CO(g)?Fe(s)+CO2(g)的平衡常数为K1.写出K1的表达式 .若该反应在恒容容器中反应时满足图3所示变化,则该反应的正反应为 反应(选填“吸热”或“放热”).若在t℃的2L恒温密闭容器中加入0.02mol FeO(s),并通入一定量CO.若5min后FeO(s)转化率为50%,则CO2的平均反应速率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应:2SO2(g)+O2(g)  2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )
2SO3(g)在一个体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内消耗n mol SO2的同时生成n mol SO2
②单位时间内消耗2n mol SO2的同时生成n mol O2
③用SO2、O2、SO3的物质的量浓度变化表示的反应速率的比为2∶1∶2的状态
④混合气体的密度不再改变的状态
A.①② B.①②④
C.①②③ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:
2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
| 容器 编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
CO可用于合 成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是___________________________________。
成甲醇,反应方程式为CO(g)+2H2(g)CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示。该反应ΔH________0(填“>”或“<”)。实际生产条件控制在250 ℃、1.3×104 kPa左右,选择此压强的理由是___________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当
温度分别在T1 ℃和T2 ℃时,测得平衡时各物质的物质的量如下表:
|
T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式:__________________。
(2)上述反应在T1 ℃时的平衡常数为K1,在T2 ℃时的平衡常数为K2。
①计算K1=__________________。
②根据上述信息判断,T1和T2的关系是__________。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是________(填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,在容积为2 L的密闭容器中发生反应CO(g)+H2O(g)  CO2(g)+H2(g),部分数据见下表(表中t2>t1)。
CO2(g)+H2(g),部分数据见下表(表中t2>t1)。
| 反应时间/min | n(CO) /mol | n(H2O) /mol | n(CO2) /mol | n(H2) /mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
下列说法正确的是 ( )
A.反应在t1 min内的反应速率为v(H2)= mol·L-1·min-1
mol·L-1·min-1
B.平衡时CO的转化率为66.67%
C.该温度下反应的平衡常数 为1
为1
D.其他条件不变,若起始时n(CO)=0.60 mol,n(H2O)=1.20 mol,则平衡时n(CO2)=0.20 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源。由合成气(组成为H2、CO和少量的CO2)直接制备二甲醚,其中的 主要过程包括以下四个反应:
主要过程包括以下四个反应:
甲醇合成反应:
(i)CO(g) + 2H2(g) = CH3OH(g ) △H1 = -90.1kJ•mol-1
) △H1 = -90.1kJ•mol-1
(ii)CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) △H2 = -49.0kJ•mol-1
水煤气变换反应:
(iii)CO(g) + H2O(g) = CO2(g) + H2 (g) △H3 = -41.1kJ•mol-1
二甲醚合成反应:
(iV)2 CH3OH(g) = CH3OCH3(g) + H2O(g) △H4 = -24.5kJ•mol-1
回答下列问题:
(1)Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是 (以化学方程式表示)。
(2)分析二甲醚合成反应(iV)对于CO转化率的影响 。
(3)由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响 。
(4)有研究者在催化剂(含Cu—Zn—Al—O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是 。

(5)二甲醚直接燃料电池具有启动快、效率高等优点,其能量密度等于甲醇直接燃料电池(5.93kW•h•kg-1)。若电解质为酸性,二甲醚直接燃料电池的负极反应为 ,一个二甲醚分子经过电化学氧化,可以产生 个电子的能量;该电池的理论输出电压为1.20V,能量密度E = (列式计算。能量密度=电池输出电能/燃料质量,1 kW•h = 3.6×106J)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某品牌消毒液包装说明的部分内容摘录如下:主要有效成分为次氯酸钠,有效氯含量8000 mg/L~10000 mg/L。可用于各类家居用品、餐具、棉织衣物等的消毒,对彩色织物可能有褪色作用,切勿用于丝绸、毛、尼龙、皮革、油漆表面,勿用于铝、铜、碳钢制品。本品须密封,置阴凉处保存。请完成以下实验探究过程:
(一)阅读材料,获取信息
(1)推测该消毒液的酸碱性:________,原因是(用离子方程式表示)________。
(2)该消毒液还具有的化学性质是________性和________性。
(3)从该消毒液的保存要求分析,导致其失效的外界因素主要是________。
(二)确定要研究的问题
该消毒液对碳钢制品是否有腐蚀作用?
(三)实验探究
用烧杯取少量样品,将一颗光亮的铁钉放入烧杯中浸泡一段时间,对可能产生的现象有如下假设:假设①:有明显现象;假设②:无明显现象。
(4)基于假设①,结论是铁钉被腐蚀,预期的实验现象是________。
(5)基于假设②,结论是________,请设计实验进一步验证该结论,叙述实验操作:
________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com