
| �������� | Fe��OH�� | Fe��OH�� | Mn0H��2 | Zn��OH��2 |
| ��ʼ������pH | 7.5 | 2.2 | 8.8 | 6.4 |
| ������ȫ��pH | 9.5 | 3.7 | 10.8 | 8.5 |
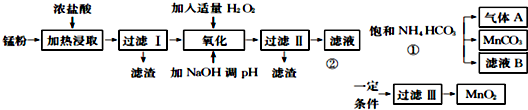
���� �̷�[��MnO2��MnO��OH����Zn��NH3��2Cl2��Fe��NH4Cl��̿�ڵ�]��Ũ�����м��ȡ���ȡ������MnO2+4HCl$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��2MnO��OH��+6HCl=2MnCl2+Cl2��+3H2O��Fe+2HCl=FeCl2+H2���ȷ�Ӧ�����˺���������Ϊ̼�ڣ���Һ�к���Mn2+��Fe2+��NH4+��Zn2+�����ӣ�����Һ�м�����������������������ƣ��ɽ�Fe2+ת��ΪFe3+��������Fe��OH��3��������ҺpH��8.5��pH��8.8֮��ɳ�ȥFe3+��Zn2+�����˺�������Һ����ҪΪMn2+��NH4+��Na+�ȣ���Һ����H2O2��Һ����һ��������ʹMn2+ת����MnO2�������ˡ�ϴ�ӡ�����ɵ�MnO2����Һ���м���̼����隣�����Һ��������ӦMn2++2HCO3-=MnCO3+CO2��+H2O���õ�̼���̳������Ȼ����Һ������AΪCO2���Դ˽����⣮
��� �⣺�̷�[��MnO2��MnO��OH����Zn��NH3��2Cl2��Fe��NH4Cl��̿�ڵ�]��Ũ�����м��ȡ���ȡ������MnO2+4HCl$\frac{\underline{\;\;��\;\;}}{\;}$MnCl2+Cl2��+2H2O��2MnO��OH��+6HCl=2MnCl2+Cl2��+3H2O��Fe+2HCl=FeCl2+H2���ȷ�Ӧ�����˺���������Ϊ̼�ڣ���Һ�к���Mn2+��Fe2+��NH4+��Zn2+�����ӣ�����Һ�м�����������������������ƣ��ɽ�Fe2+ת��ΪFe3+��������Fe��OH��3��������ҺpH��8.5��pH��8.8֮����Գ�ȥFe3+��Zn2+�����˺�������Һ����ҪΪMn2+����Һ����H2O2��Һ����һ��������ʹMn2+ת����MnO2�������ˡ�ϴ�ӡ�����ɵ�MnO2����Һ���м���̼����隣�����Һ��������ӦMn2++2HCO3-=MnCO3+CO2��+H2O���õ�̼���̳������Ȼ����Һ������AΪCO2��
��1����������ķ�����֪�����ˢ�õ���������Ҫ�ɷ���̼�ڣ�
�ʴ�Ϊ��̼�ڣ�
��2�����������������NaOH��Һ����pH�ķ�ΧΪ8.5��pH��8.8���������dz�ȥFe3+��Zn2+��
�ʴ�Ϊ����ȥFe3+��Zn2+��
��3�����ˢ����Һ����������Ҫ��Mn2+��NH4+��Na+��
�ʴ�Ϊ��Mn2+��NH4+��Na+��
��4����Һ���м���̼����隣�����Һ��������ӦMn2++2HCO3-=MnCO3+CO2��+H2O������A�� CO2��CO2ѭ�����ã�������������NH4HCO3����ҺB�к���NH4Cl���ɷ����������ʣ�
�ʴ�Ϊ��Mn2++2HCO3-=MnCO3+CO2��+H2O��CO2ѭ�����ã���������NH4HCO3����ҺB�к���NH4Cl���ɷ����������ʣ�
��5�����̢ڵõ�MnO2����MnO2������Һ��ͨS02��ԭ�ɵ�MnSO4���䷴Ӧ����ʽΪ��MnO2+S02=MnSO4����MnS04��Һ�м���Na2C03��NaHC03�Ʊ�MnC03���ӱ߽��裬Ϊ�˷�ֹ������ˮ�����ɳ�������Һ��pHҪС��8.8��
�ʴ�Ϊ��MnO2+S02=MnSO4���߽������Na2C03��NaHC03����������Һ��pH��8.8��
���� ����ͨ��MnO2��MnCO3���Ʊ��������������Ʊ�ʵ�鷽������Ʒ�������Ŀ�ѶȽϴ���ȷ�Ʊ����̼���Ӧ�ķ�Ӧԭ��Ϊ���ؼ��������漰��֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ�����ѧ���ķ�����������������ѧʵ��������


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ӦΪO2+2H2O+4e-=4OH- | |
| B�� | �ŵ�ʱ��������������Ӧ�����·�е��Ӵ��������� | |
| C�� | ������ӦΪCH4+10OH--8e-=CO32-+7H2O | |
| D�� | ���ŷŵ�Ľ��У���Һ��pH���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
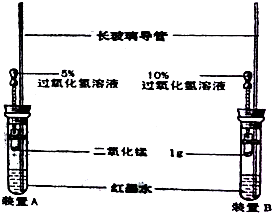 С����ͼװ����ʵ��װ�ã�����ͷ�ι��еĹ���������Һ�����ȣ�Ũ�ȷֱ�Ϊ5%��10%����ʵ��ʱ��ͬʱ��ȫ������ιܵĽ�ͷ�����۲�ʵ������
С����ͼװ����ʵ��װ�ã�����ͷ�ι��еĹ���������Һ�����ȣ�Ũ�ȷֱ�Ϊ5%��10%����ʵ��ʱ��ͬʱ��ȫ������ιܵĽ�ͷ�����۲�ʵ�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
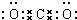 ��
��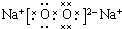 ������ڵĻ�ѧ�������Ӽ��ͷǼ��Լ�
������ڵĻ�ѧ�������Ӽ��ͷǼ��Լ�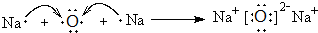 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
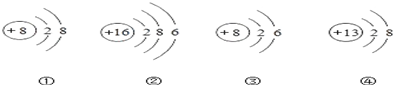
| A�� | �ܱ�ʾ���������� | |
| B�� | ?�٢�����ͬ��Ԫ�أ�?�ڢ�������һ��Ԫ�� | |
| C�� | ?�ڢ��γɵĻ�������Al2O3 | |
| D�� | �٢۵Ļ�ѧ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
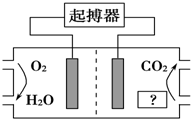 ��ͼ��ʾ���������ҽѧ����������������������������������䶯����������Һ�е����������ṩ�������й�˵����ȷ���ǣ�������
��ͼ��ʾ���������ҽѧ����������������������������������䶯����������Һ�е����������ṩ�������й�˵����ȷ���ǣ�������| A�� | ͼ�С�����Ϊ�����е�֬�� | |
| B�� | O2��Ϊ���������ĸ��� | |
| C�� | ������CO2ʹ����ѪҺ�����ԣ�����ʹ�ö������к� | |
| D�� | ��������ĵ缫��ӦʽΪO2+4H++4e-�T2H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢ� | B�� | �ڢۢ� | C�� | �ڢۢܢ� | D�� | �٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
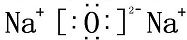 ��ˮ��ҺPH=8����C��HY-��+2C��H2Y��=10-6-10-8mol/L���ȷֵ����
��ˮ��ҺPH=8����C��HY-��+2C��H2Y��=10-6-10-8mol/L���ȷֵ�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com