
| A.H2O2、Na2O2都属于过氧化物,都存在共价键 |
| B.双氧水是绿色氧化剂,可作医疗消毒剂 |
| C.H2O2在过氧化氢酶的催化下,温度越高,分解速率越快 |
| D.H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似、与SO2不同 |
科目:高中化学 来源:不详 题型:实验题
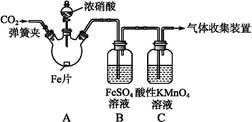
 Fe(NO)SO4(棕色) ΔH<0。
Fe(NO)SO4(棕色) ΔH<0。| 实验操作 | 实验现象 |
| 打开弹簧夹,通入一段时间CO2,关闭弹簧夹。 | |
| 打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
| 加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅;B中溶液变棕色;C中溶液紫色变浅。 ②反应停止后,A中无固体剩余。 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

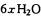 。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
。某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
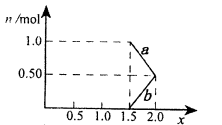
| A.原混合液中NO3-的物质的量为0.4mol |
| B.c(H2SO4)为5mol·L-1 |
| C.溶液中最终溶质为FeSO4 |
| D.OA段产生是NO,AB段反应为2Fe3++Fe = 3Fe2+,BC段产生氢气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
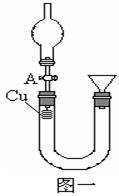
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
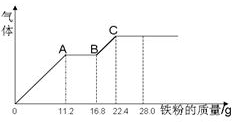
| A.剩余的5.44g金属为铁 | B.剩余5.44g金属为铜 |
| C.共生成NO气体 0.03mol | D.8.08g金属中铁的质量分数为0.208 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硝酸与金属反应时,主要是+5价的氮得电子 |
| B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水 |
| C.硝酸电离出的H+离子,能被Zn、Fe等金属还原成H2 |
| D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com