

| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| Li2CO3 | 1.54 | 1.43 | 1.33 | 1.25 | 1.17 | 1.08 | 1.01 | 0.85 | 0.72 |
分析 (1)根据化合价代数和为0确定x的值,硅酸盐改为氧化物形成,按照活泼金属氧化物、较不活泼金属氧化物、二氧化硅、水顺序书写,注意氧化物形式与盐中原子数目关系对应;
(2)根据流程图中标注的浓硫酸的沸点分析,硫酸如果加入过多会增加调节pH值时的耗碱量;
(3)水浸时,需要在搅拌下加入石灰石粉末中和调节pH值;
(4)硫酸锂和碳酸钠反应生成碳酸锂和硫酸钠;
(5)由表格可知,温度越高,Li2CO3的溶解度越小,得到的Li2CO3越多.
解答 解:(1)根据化合价代数和为0,可以确定Li2Al2Si4Ox中x=$\frac{1×2+3×2+4×4}{2}$=12,Li2Al2Si4O12用氧化物的形式表示为Li2O•Al2O3•4SiO2,
故答案为:Li2O•Al2O3•4SiO2;
(2)流程图中标注的浓硫酸的沸点为338℃,硫酸化焙烧工业反应温度不能高于浓硫酸的沸点,温度太低反应速率慢,因此温度控制在250~300℃,硫酸如果加入过多会增加调节pH值时的耗碱量,
故答案为:防止浓硫酸蒸发;C;
(3)水浸时,需要在搅拌下加入石灰石粉末的主要作用是中和过量的浓硫酸,
故答案为:中和过量的浓硫酸;
(4)“沉锂”通过完成液(Li2SO4的水溶液)和碱液在容器中按一定比例混合进行沉淀反应产出固相的碳酸锂产品,“沉锂”过程中发生的反应是硫酸锂和碳酸钠反应生成碳酸锂和硫酸钠,化学方程式为Li2SO4+Na2CO3=Li2CO3↓+Na2SO4,
故答案为:Li2SO4+Na2CO3=Li2CO3↓+Na2SO4;
(5)由表格可知,温度越高,Li2CO3的溶解度越小,得到的Li2CO3越多,“沉锂”需要在95℃以上进行,主要原因是Li2CO3的溶解度小,得到的Li2CO3多,
故答案为:Li2CO3的溶解度小,得到的Li2CO3多.
点评 本题考查了碳酸锂的制备,难度较大,了解硫酸化焙烧和“沉锂”过程尤为关键,需要将所学物质的性质与无机物生产工艺合二为一.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
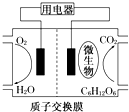
| A. | 该电池不能够在高温下工作 | |
| B. | 电池的负极反应:C6H12O6+6H2O-24e-═6CO2↑+24H+ | |
| C. | 放电过程中,H+会从负极区向正极区迁移 | |
| D. | 在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体$\frac{22.4}{6}$ L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 发生的化学反应是复分解反应 | |
| B. | 反应的生成物中有Na2CO3 | |
| C. | 反应后形成的混合物的聚集颗粒直径为1~100nm | |
| D. | 反应说明硅酸易溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
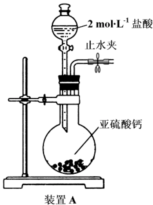


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
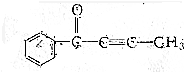 的有机化合物分子中:
的有机化合物分子中:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
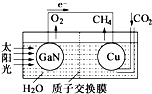 人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.科学家用氮化镓材料与铜组装如图的人工光合系统,成功地实现了以CO2和H2O合成CH4,下列说法不正确的是( )| A. | 该过程是将太阳能转化为化学能的过程 | |
| B. | GaN表面发生氧化反应,有O2产生 | |
| C. | 电解液中的H+从质子交换膜右侧向左侧迁移 | |
| D. | Cu表面的电极反应式 CO2+8e-+8H+═CH4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com