
在一个容积为2L的密闭容器中,发生如下反应:3A+B=2C (A、B、C均为气体),若最初加入的A、B都是4mol,A的平均反应速率为0.12mol/L·s,则10s后容器中的B是
A.2.8mol  B.1.6mol C.3.2mol D.3.6mol
B.1.6mol C.3.2mol D.3.6mol
科目:高中化学 来源:2017届浙江省名校协作体高三上学期联考化学试卷(解析版) 题型:填空题
二氧化碳的回收利用是环保领域研究热点。
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如右图所示。总反应的化学方程式为 。

(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O。已知298K和101KPa条件下:
CH3OH+H2O。已知298K和101KPa条件下:
CO2(g)+3H2(g) CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
CH3OH(g)+H2O(l) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) △H=-b kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-c kJ·mol-1,
则CH3OH(l)的标准燃烧热△H=___________________。
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为
2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H<0
CH2= CH2(g) +4H2O(g) △H<0
在恒容密闭容器中充入2 mol CO2和n mol H2,在一定条件下发生反应,CO2的转化率与温度、投料比 的关系如右图所示。
的关系如右图所示。
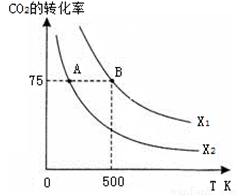
①平衡常数KA KB
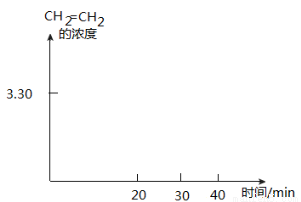
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如下:
时间(min) 浓度(mol·L-1) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30 min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2 B.通入一定量CH2=CH2
C.加入合适催化剂 D.缩小容器体积
画出CH2=CH2的浓度随反应时间的变化曲线。
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2 (g)+ 6H2(g) CH2= CH2(g) +4H2O(g) △H< 0
CH2= CH2(g) +4H2O(g) △H< 0
B.2CO2(g) + 6H2(g)  CH3OCH3(g)+3H2O(g) △H< 0
CH3OCH3(g)+3H2O(g) △H< 0

上图是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低 B.A反应的平衡常数变大
C.生成甲醚的量增加 D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2。常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10-7 ,Ka2=5×10-11,则0.5mol·L-1的Na2CO3溶液的pH等于 (不考虑第二步水解和H2O的电离)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高二上第一次月考化学试卷(解析版) 题型:选择题
在恒温恒容的密闭容器中,发生反应:3A(g)+B(g)  xC(g)Ⅰ.将3mol A和2mol B,在一定条件下反应,达到平衡时C的体积分数为a;Ⅱ.若A、B、C起始投入的物质的量分别为n(A)、n(B)、n(C),在相同条件下达到平衡时,C的体积分数也为A.下列有关叙述正确的是
xC(g)Ⅰ.将3mol A和2mol B,在一定条件下反应,达到平衡时C的体积分数为a;Ⅱ.若A、B、C起始投入的物质的量分别为n(A)、n(B)、n(C),在相同条件下达到平衡时,C的体积分数也为A.下列有关叙述正确的是
A.若Ⅰ达到平衡时,A、B、C各增加1mol,则B的转化率一定增大
B.若向平衡Ⅰ中再加入6mol A,4mol B.测得C的体积分数大于a,可断定x>4
C.若x=2,则体系Ⅱ起始物质的量应满足:3n(B)=n(A)-3
D.若体系Ⅱ起始物质的量满足3n(c)+4nA=12nB,则可推断:x=4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上第一次月考化学卷(解析版) 题型:实验题
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯上如不盖硬纸板,求得的中和热数值 (填“偏大、偏小、无影响”)
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等、不相等”),所求中和热 (填“相等、不相等”),简述理由 。
(5)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会 ;(填“偏大”、“偏小”、“无影响”)。
(6)实验时所用盐酸及NaOH溶液的密度均为1g/cm3,生成溶液的比热容C=4.18J/(g·℃),实验起始温度为t1℃,终止温度为t2℃。试推断中和热的计算式:△H=____________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上第一次月考化学卷(解析版) 题型:选择题
对于固定体积的密闭容器中进行的气体反应可以说明A(g) + B(g) C(g)+D(g)在恒温下已达到平衡的是
C(g)+D(g)在恒温下已达到平衡的是
A.反应容器的压强不随时间而变化
B.A气体和B气体的生成速率相等
C.A、B、C三种气体的生成速率相等
D.反应混合气体的密度不随时间而变化
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏高二上第一次月考化学卷(解析版) 题型:选择题
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ/mol、-1411.0kJ/mol和-1366.8kJ/mol,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为
A.-44.2kJ/mol B.+44.2kJ/mol C.-330kJ/mol D.+330kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上10月月考化学试卷(解析版) 题型:填空题
常温常压下断裂1 mol(理想)气体分子化学键所吸收的能量或形成1 mol(理想)气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)。下表是一些键能数据(kJ·mol-1):
化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
C-F | 427 | C-Cl | 330 | C-I | 218 |
H-H | 436 | S=S | 255 | H-S | 339 |
请完成下列问题。
(1)由表中数据规律预测C-Br键的键能范围:_ <C-Br键能< (填写数值和单位)
(2)热化学方程式2H2(g)+S2(g)=2H2S(g) ΔH= Q kJ·mol-1;则Q= __
(3) 已知下列热化学方程式:
O2 (g) = O (g)+e- ΔH1= +1175.7 kJ·mol-1
(g)+e- ΔH1= +1175.7 kJ·mol-1
PtF6(g)+e-= PtF (g) ΔH2= —771.1 kJ·mol-1
(g) ΔH2= —771.1 kJ·mol-1
O PtF
PtF (s) = O
(s) = O (g)+PtF
(g)+PtF (g) ΔH3= +482.2 kJ·mol-1
(g) ΔH3= +482.2 kJ·mol-1
则反应O2(g) +___ ___(g)=O PtF
PtF (s) ΔH=___ ___kJ·mol-1。
(s) ΔH=___ ___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上10月月考化学试卷(解析版) 题型:选择题
已知反应①2BrO3-+Cl2=Br2+2ClO3-
②5Cl2+I2+6H2O=2HIO3+10HCl
③ClO3-+5Cl-+6H+=3Cl2+3H2O,下列物质氧化能力强弱顺序正确的是
A.ClO3->BrO3->IO3->Cl2 B.BrO3- >Cl2>C1O3->IO3-
C.BrO3->ClO3->Cl2>IO3- D.Cl2>BrO3->C1O3->IO3-
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第二次月考化学试卷(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是( )
A.空气:HCl、CO2、SO2、NO
B.烧碱溶液:K+、HCO 、NO
、NO 、NH3·H2O
、NH3·H2O
C.高锰酸钾溶液:H+、Na+、SO 、CH3COOH
、CH3COOH
D.氢氧化铁胶体:H+、K+、S2-、Br-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com