


科目:高中化学 来源:不详 题型:单选题
| A.用盐酸可以洗去铜表面的铜锈 |
| B.向氯化铁溶液中加入适量氧化铜固体,可得到红褐色沉淀 |
| C.0.1mol/L的CuSO4溶液中,Cu2+的微粒数目一定小于0.1NA(设NA为阿伏伽德罗常数) |
| D.在FeSO4溶液中加入CuS固体,溶液中c(Fe2+)不变,说明Ksp(CuS)远小于Ksp(FeS) |
查看答案和解析>>
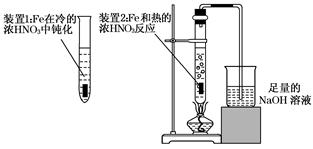
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.KSCN溶液和氯水 | B.铁粉和KSCN溶液 | C.浓氨水 | D.酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
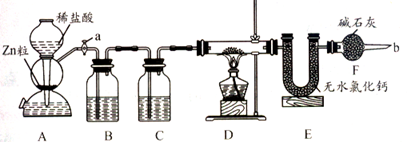
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
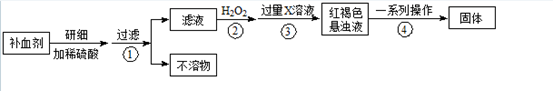
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H+ | B.Fe2+ | C.Fe3+ | D.Cu2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硬度比生铁低 | B.与4mol/L的HCl反应时速率比生铁快 |
| C.在冷的浓硫酸中可钝化 | D.在潮湿的空气中不易生锈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com