
| A. | 全部 | B. | ③④ | C. | ②④ | D. | ①②④ |
分析 ①强酸溶液加水稀释后,溶液中氢离子浓度降低,氢氧根离子浓度增大;
②c(H+)=10-pH;
③酸的电离平衡常数、酸根离子水解平衡常数与水的离子积常数之间的关系为Ka•Kh=Kw;
④反应A(g)?2B(g),若正反应的活化能为Ea kJ•mol-1,逆反应的活化能为Eb kJ•mol-1,反应的焓变等于正逆反应活化能之差.
解答 解:①pH=1的强酸溶液,加水稀释后,溶液中c(H+)减小,温度不变,则水的离子积常数不变,则c(OH-)增大,故错误;
②c(H+)=10-pH,pH=2的盐酸和pH=1的醋酸,c(H+)之比为=0.01mol/L:0.1mol/L=1:10,故错误;
③已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh,水的离子积为Kw,则三者关系为:Ka•Kh=$\frac{c(C{H}_{3}CO{O}^{-}).c({H}^{+})}{c(C{H}_{3}COOH)}$×$\frac{c(C{H}_{3}COOH).c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=Kw,故正确;
④逆反应的活化能=正反应的活化能+反应的焓变,所以△H=逆反应的活化能-正反应的活化能=(Ea-Eb)kJ•mol-1,故正确;
故选B.
点评 本题考查较综合,涉及弱电解质的电离、盐类水解、焓变等知识点,注意稀释酸或碱中并不是所有粒子都减小,知道酸的电离平衡常数、酸根离子水解平衡常数与离子积常数之间的关系式,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 燃煤时加入适量石灰石,可减少废气中SO2的含量 | |
| B. | 京津冀、长三角、珠三角雾霾的形成与煤的燃烧、化工厂大量排放含硫、含氮氧化物、颗粒物和汽车排放的尾气等有关 | |
| C. | pH小于7.0的降雨通常称为酸雨 | |
| D. | 使用洁净能源、为汽车安装尾气转化装置、对硝酸厂排放的废气进行碱处理能有效控制氮氧化物对空气的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于0.9mol | B. | 等于0.9mol | ||
| C. | 在0.45mol与0.9mol之间 | D. | 大于0.9mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y在周期表中的位置是第4周期ⅢB族 | |
| B. | 属于非金属元素 | |
| C. | ${\;}_{39}^{89}$Y和${\;}_{39}^{89}$Y是两种不同的核素 | |
| D. | 核素${\;}_{39}^{89}$Y的质子数与中子数之差为50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
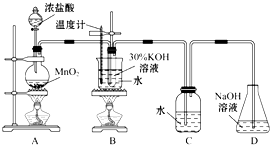 某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2.24LH2O中分子的数目为0.1NA | |
| B. | 0.1mol•L-1NH4Cl溶液中含有Cl-的数目为0.1NA | |
| C. | 常温下,1.7gNH3中含有氢原子数目为0.3 NA | |
| D. | 5.6g铁粉在足量的氯气中充分燃烧,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①>②>③>④>⑤ | B. | ⑤>④>③>②>① | C. | ③>①>④>②>⑤ | D. | ③>④>⑤>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若原料完全反应成上述产物,CH3CH2Br与NH3的物质的量之比为2:1 | |
| B. | CH3CH2Br和HBr均属于电解质 | |
| C. | 该反应属于取代反应 | |
| D. | CH3CH2Br难溶于水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com