
| A. | 5种 | B. | 6种 | C. | 7种 | D. | 4种 |
分析 先根据商余法确定相对分子质量为70的烃的分子式,然后根据该有机物能够使溴水褪色确定其含有官能团,最后利用同分异构体的书写原则写出满足条件的有机物的结构简式.
解答 解:根据$\frac{70}{14}$=5可知该烃的分子式为:C5H10,该烃能使溴的CCl4溶液褪色,则该有机物分子中含有碳碳双键,为戊烯,
主链含有5个C时的戊烯有:CH3CH2CH2CH=CH2、CH3CH=CHCH2CH3;
主链含有4个C的戊烯有:CH2=C(CH3)CH2CH3、CH3(CH3)C=CHCH3、CH3(CH3)CHCH=CH2,
主链含有3个C时无法添加碳碳双键,则不存在该戊烯,
所以满足添加的有机物的结构简式有5种,
故选A.
点评 本题考查了同分异构体的书写方法,题目难度不大,根据题干信息确定该有机物分子式及含有官能团类型为解答关键,注意熟练掌握同分异构体的书写原则,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
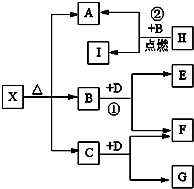 Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题:
Ⅰ有A、B、C、D、E五种短周期主族元素,它们的原子序数依次增大.A元素的原子是半径最小的原子,B元素的最高价氧化物的水化物与其氢化物反应生成一种盐X,D与A同族,且与E同周期,E元素的最外层电子数是次外层电子数的3/4倍.A、B、D、E这四种元素,每一种都能与C元素形成原子个数比不相同的多种化合物.回答下列问题: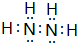 .将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O.
.将N2H4和O2通入到由A、C、D三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为N2H4-4e-+4OH-=N2↑+4H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | c(一元酸)/mol•L-1 | c(KOH)/mol•L-1 | 反应后溶液 |
| ① | c(HX)=0.10 | 0.1 | pH=b |
| ② | c(HY)=0.10 | 0.1 | pH=7 |
| ③ | c(HZ)=0.10 | 0.1 | pH=10 |
| ④ | c(HZ)=0.20 | 0.1 | pH<7 |
| A. | 实验①反应后的溶液中:c(X-)=0.05mol•L-1或c(X-)+c(HX)=0.05mol•L-1且不小于7 | |
| B. | 实验②反应时发生的离子方程式为H++OH-═H2O,则c(K+)=c(Y-)=c(OH-)=c(H+) | |
| C. | 实验③反应后的溶液中:c(K+)=c(Z-)=10-3 | |
| D. | 实验④反应后的溶液中:c(Z-)+c(OH-)<c(K+)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Br-<Fe2+<I- | B. | I-<Fe2+<Br- | C. | Br-<I-<Fe2+ | D. | Fe2+<Br-<I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
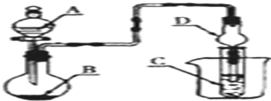
| A. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色 | |
| B. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解 | |
| C. | 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| D. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气、氯水、液氯是同一种物质,只是状态不同 | |
| B. | 氯水和液氯都可以使干燥的布条褪色 | |
| C. | 用氯气消毒过的自来水配制硝酸银溶液时,药品不会变质 | |
| D. | 氯水溶液呈浅绿色,且有刺激性气味,说明氯水中有Cl2存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com