
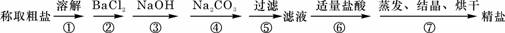
 (5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流
(5)为检验精盐纯度,需配制100mL 1mol/L NaCl溶液,右图是该同学转移溶液的示意图,图中的错误是未用玻璃棒引流分析 (1)依据实验原理结合过滤实验用到的仪器来回答;
(2)第④步中,碳酸根离子和钡离子、钙离子反应;
(3)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(4)碳酸钠可以将钙离子以及过量的钡离子沉淀下来;除镁离子用氢氧化钠,除钙离子用碳酸钠,除硫酸根离子用氯化钡,所加试剂要过量,为了将多余的杂质除掉,碳酸钠必须放在氯化钡的后面;
(5)向容量瓶中转移溶液要用玻璃棒引流;
(6)配制100mL 1mol/L NaCl溶液过程中,使结果偏低,则氯化钠的质量偏小或溶液的体积偏大.
解答 解:(1)过滤装置是分离难溶性物质和溶液的分离方法,用到的玻璃仪器为:烧杯、玻璃棒、漏斗,
故答案为:玻璃棒;漏斗;
(2)第④步中,碳酸根离子和钡离子、钙离子反应,反应的离子方程式为:CO32-+Ca2+=CaCO3↓、CO32-+Ba2+=BaCO3↓;
故答案为:CO32-+Ca2+=CaCO3↓、CO32-+Ba2+=BaCO3↓;
(3)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②步后的上层清液(或取少量上层清液于试管中),再滴入适量BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取少量上层清液,滴加BaCl2溶液,若不再产生沉淀,即证明BaCl2已过量;
(4)除杂试剂为了完全除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下来,BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸至不再有气体生成即可,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH)
故答案为:NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH);
(5)向容量瓶中转移溶液要用玻璃棒引流,图中未用玻璃棒引流;
故答案为:未用玻璃棒引流;
(6)A.称量时,托盘天平左盘加砝码,右盘加氯化钠,会使氯化钠的质量偏小,会使结果偏低,故A正确;
B.移液前,容量瓶中有少量蒸馏水未倒出,对实验结果无影响,故B错误;
C.定容时,仰视容量瓶刻度线观察液面,溶液的体积偏大,会使结果偏低,故C正确;
D.定容后,倒置容量瓶摇匀经平放静置,液面低于刻度线,对实验结果无影响,故D错误.
故答案为:AC.
点评 本题是一道物质的分离和提纯的方法和基本操作以及溶液浓度配制的综合应用题,要求学生具有分析和解决问题的能力,难度较大,注意把握分离提纯的操作方法和溶液配制的注意事项.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯甲酸和苯甲酸钠都是食品防腐剂 | |
| B. | 食用花生油和汽油都属于酯 | |
| C. | 包装用材料聚乙烯和聚氯乙烯都属于烃 | |
| D. | 毛发、鸡蛋清都不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
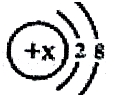 当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.
当x=8时,该粒子符号为O2-;当x=11时,该粒子符号为Na+;当x=13时,写出该粒子的硝酸盐的化学式为Al(NO3)3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
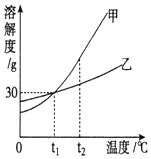 图是甲、乙两种固体物质的溶解度曲线.
图是甲、乙两种固体物质的溶解度曲线.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅在自然界中既有游离态又有化合态 | |
| B. | 高温下SiO2能与Na2CO3固体反应生成Na2SiO3和CO2,说明硅酸酸性强于碳酸 | |
| C. | 因为玻璃中含有SiO2,所以不能用磨口玻璃塞的试剂瓶盛装碱性溶液 | |
| D. | SiO2能与氢氧化钠溶液和氢氟酸反应,所以SiO2是两性氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com