
| A、半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 |
| B、将“地沟油”制成肥皂,可以提高资源的利用率 |
| C、我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 |
| D、减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |


科目:高中化学 来源: 题型:
| A、NaClO3在反应中被氧化 |
| B、1mol NaClO3参加反应有2mol电子转移 |
| C、氧化性ClO2>NaClO3 |
| D、氧化产物与还原产物的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
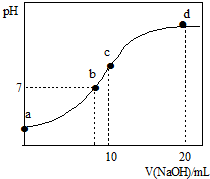 常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )
常温下,向20.00mL 0.1000mol?L-1(NH4)2SO4溶液中逐滴加入0.2000mol?L-1 NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( )| A、点a所示溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) |
| B、点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH-) |
| C、点c所示溶液中:c(SO42-)+c(H+)=c(NH3?H2O )+c(OH-) |
| D、点d所示溶液中:c(SO42-)>c(NH3?H2O )>c(OH-)>c(NH4+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用坩埚灼烧MgCl2?6H2O的化学反应方程式:MgCl2?6H2O
| ||||
| B、KSCN和FeCl3混合液存在着平衡:3KSCN+FeCl3?Fe(SCN)3+3KCl,加入少量KCl固体后溶液颜色不发生变化 | ||||
| C、常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一 | ||||
D、 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)?c(SO42-).则加入Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d点变到c点 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、A、B两元素能形成多种化合物 |
| B、D、E两元素的最高价氧化物对应的水化物可相互反应 |
| C、C的气态氢化物的稳定性一定大于F的气态氢化物 |
| D、C、F两种元素可以形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氨基甲酸铵常用于生产医药试剂、发酵促进剂、电子元件等,是一种可贵的氨化剂.某学习小组研究在实验室中制备氨基甲酸铵的化学原理.
氨基甲酸铵常用于生产医药试剂、发酵促进剂、电子元件等,是一种可贵的氨化剂.某学习小组研究在实验室中制备氨基甲酸铵的化学原理.| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当阴极产物为铜时,阳极产物一定为氯气 |
| B、当阳极产物为氯气时,阴极上一定会析出铜 |
| C、整个过程中阳极先产生氯气,后产生氧气 |
| D、电解到最后阶段,溶液中的溶质为硫酸钠和硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com