
| A.煤的干馏 | B.石油的分馏 | C.石油的裂化 | D.石油的裂解 |
科目:高中化学 来源:不详 题型:填空题
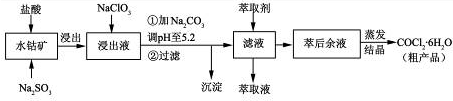
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
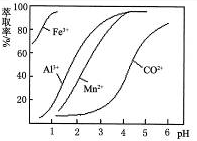
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
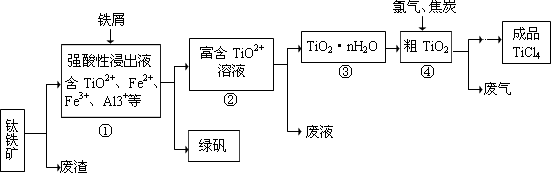
| | TiCl4 | SiCl4 |
| 熔点/℃ | -25.0 | -68.8 |
| 沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.蛋白质、纤维、蔗糖、聚乙烯、淀粉都是高分子化合物 |
| B.研制乙醇汽油(汽油中添加一定比例的乙醇)技术,可以降低机动车辆尾气中有害气体排放 |
| C.使用太阳能热水器、沼气的利用、玉米制乙醇都涉及到生物质能的利用 |
| D.石油、煤、天然气、可燃冰、植物油都属于化石燃料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 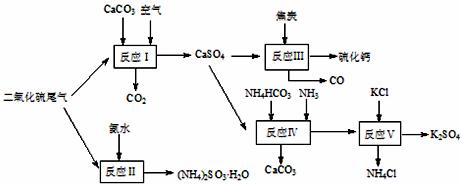
 中加入适量的对苯二酚等物质,其目的是 ▲ 。
中加入适量的对苯二酚等物质,其目的是 ▲ 。| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的
可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的 分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是 能转化为 能。
分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是 能转化为 能。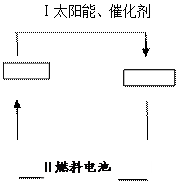
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com