
分析 (1)设此烷烃的分子式为CnH2n+2,利用C、H原子守恒列式计算出n即可;
(2)根据(1)的计算结果及同分异构体的书写原则形成此烷烃可能的结构,然后根据烷烃的命名原子写出其名称.
解答 解:(1)设此烷烃的分子式为CnH2n+2,0.4mol二氧化碳中含有0.4molC原子,0.5mol水分子中含有1molH原子,则:
n:(2n+2)=0.4mol:1mol,
解得:n=4,
则该烷烃的分子式为:C4H10,
答:该烷烃的分子式为C4H10;
(2)该烷烃的分子式为C4H10,是丁烷,丁烷存在正丁烷和异丁烷两种同分异构体,其可能结构及名称为:正丁烷:CH3CH2CH3CH3,异丁烷:CH3CH(CH3)2(也就是2-甲基丙烷),
答:该烷烃的结构及名称为正丁烷:CH3CH2CH3CH3,异丁烷:CH3CH(CH3)2(也就是2-甲基丙烷).
点评 本题考查了有机物分子式、结构简式的确定及有机物命名,题目难度不大,明确烷烃的组成、烷烃的命名原则为解答关键,试题培养了学生的分析能力及灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中加入醋酸 H++OH-═H2O | |
| B. | 向稀硫酸溶液中投入铁粉 2Fe+6H+═2Fe3++3H2↑ | |
| C. | 向碳酸钠溶液中加入盐酸 CO32-+2H+═H2O+CO2↑ | |
| D. | 氧化铜溶于盐酸 O2-+2H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解熔融氯化镁制镁蒸汽 | |
| B. | 工业上用钠和熔融氯化钾反应制取钾(850℃) | |
| C. | 工业上用碳酸钠制取碳酸氢钠 | |
| D. | 工业上炼铁时,常用石灰石除去铁矿石中的SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
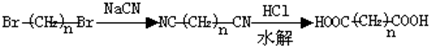 现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下:
现用乙烯和其它无机物为原料合成环状有机物E(C6H8O4)的流程如下: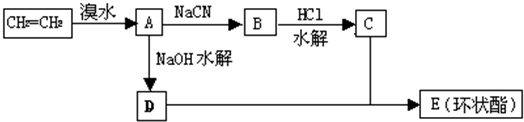
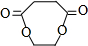 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
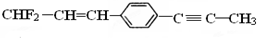
| A. | 所有原子共面 | |
| B. | 12个碳原子不可能共平面 | |
| C. | 除苯环外的其余碳原子不可能共直线 | |
| D. | 除苯环外的其余碳原子可能共直线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com