
【题目】用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,反应如下:3SiCl4 +2N2 +6H2![]() Si3N4 +12HCl。
Si3N4 +12HCl。
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于_____________晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是______________(填写元素符号);属于非极性分子的化合物的电子式是__________。
(2)比较Si和Cl两种元素非金属性强弱的方法是__________。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为_________________(简述理由),写出Si与强碱溶液反应的离子反应方程式:____________________________。
【答案】 原子 H、Cl 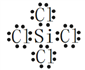 b 处在金属与非金属的分界线上 Si+2OH-+H2O=SiO32-+2H2↑
b 处在金属与非金属的分界线上 Si+2OH-+H2O=SiO32-+2H2↑
【解析】(1)氮化硅是一种新型的无机非金属材料,耐高温,属于原子晶体;H、N、Si、Cl四种原子的最外层电子构型分别为1s1、2s22p3、3s23p2、3s23p5,最外层未成对电子数分别为1、3、2、1,所以原子最外层只有一个未成对电子的元素是H和Cl;SiCl4为非极性分子,其电子式为: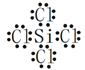 。
。
(2)气态氢化物沸点的大小与分子间作用力及氢键有关,与非金属性无关,a错误;原子获得一个电子时释放的能量越大,元素的非金属性越大,b正确;最高价氧化物的水化物的酸性越强,元素的非金属性越大,而不是指氢化物的酸性,c错误,故可以比较Si和Cl两种元素非金属性强弱的方法是答案b。
(3)Si、 Al、Be三种元素均处于金属与非金属元素的交界处,所以三者的化学性质相似;
Si与强碱溶液反应的离子反应方程式为:Si+2OH-+H2O=SiO32-+2H2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.在2L密闭容器内,800℃时反应:2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(moll) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)下图中表示NO2的变化的曲线是___________(填字母);
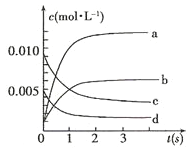
(2)800℃,反应达到平衡时,NO的转化率是___________;
(3)用O2表示从0~2s内该反应的平均速率v=___________。
Ⅱ.将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
(1)下列不能判断该分解反应已经达到化学平衡状态的是___________(填选项);
A.2v生(NH3)=v耗(CO2) B.密闭容器中氨气的物质的量不变
C.容器中CO2与NH3的物质的量之比保持不变 D.密闭容器中总压强保持不变
E.形成6个N-H键的同时有2个C=O键断裂
(2)能使该反应的反应速率增大的是___________(填选项);
A.及时分离出CO2气体 B.适当升高温度
C.加入少量NH2COONH4(s) D.选择高效催化剂
(3)如图所示,上述反应中断开反应物中化学键吸收的能量___________形成生成物中化学键放出的能量(填写“大于”“等于”“小于”)。
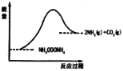
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示.
已知1mol SO2(g)氧化为1mol SO3(g)的△H=﹣99kJmol﹣1 . 请回答下列问题:
(1)图中A、C分别表示
(2)E的大小对该反应的反应热有无影响? . 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? , 理由是
(3)图中△H=KJmol﹣1 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素的原子随着原子序数的递增,有关递变不正确的是( )
A.最高正价:P<S<Cl<Ar
B.金属性:Na<K<Rb<Cs
C.原子半径:C>N>O>F
D.最外层电子数:Na<Mg<Al<Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:
2CO(g)+O2(g)=2CO2(g)△H=﹣566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g)△H=﹣266kJ/mol
O2(g)△H=﹣266kJ/mol
试回答:
(1)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为: .
(2)沼气是一种能源,它主要成分是CH4 . 0.5mol CH4完全燃烧生成CO2和液态水时,放出445kJ热量,则其燃烧的热化学方程式为: .
(3)SiH4是一种无色的气体,遇到空气能发生爆炸性自燃,生成SiO2(s)和H2O(l),已知室温下3.2gSiH4自燃放出热量79.2kJ,其热化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
![]()
A. Y的原子半径比X的大
B. Q的最高价氧化物的水化物的酸性比Z的强
C. X、Y和氢3种元素形成的化合物中都只有共价键
D. Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A+B3C+4D中,表示该反应速率最快的是( )
A.υ(A)=0.5molL﹣1S﹣1
B.υ(B)=0.3 molL﹣1S﹣1
C.υ(C)=0.8molL﹣1S﹣1
D.υ(D)=1 molL﹣1S﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了实现“将全球温度上升控制在2℃以内”,科学家正在研究温室气体CH4和CO2的转化和利用。
(1)下列说法正确的是__________(填序号)。
A. CH4与CO2分子均为含有极性共价键的非极性分子 B. 第一电离能:O>N>C
C. 沸点高低:CH4>SnH4>GeH4>SiH4 D. CH![]() 离子的空间构型为平面正三角形
离子的空间构型为平面正三角形
(2)CH4和CO2在Ni催化作用下反应可获得化工原料CO和H2。
①Ni基态原子核外电子排布式为__________。
②与CO互为等电子体的阴离子的电子式为__________,Ni能与CO形成正四面体形的配合物Ni(CO)4,1 mol Ni(CO)4中含有σ键的数目为__________。
(3)CH4和CO2在含有钛氧化物的某种催化剂作用下,可直接转化为CH3COOH。
①CH3COOH中C原子轨道杂化类型为__________;
②钛氧化物晶胞结构如图所示,写出其化学式:__________。
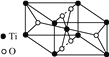
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com