
| A. | CaCl2溶液中通入CO2:Ca2++CO2+H2O═CaCO3↓+2H+ | |
| B. | 酸性KMnO4溶液中通入SO2:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+ | |
| C. | FeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| D. | AgCl悬浊液中通HI:Ag++HI═AgI↓+H+ |
分析 A.碳酸的酸性弱于盐酸;
B.高锰酸钾具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
C.氯气足量二价铁离子、溴离子都被氧化;
D.碘化氢为强电解质,应拆成离子,氯化银为沉淀,应保留化学式.
解答 解:A.碳酸的酸性弱于盐酸,二氧化碳通入氯化钙溶液不反应,故A错误;
B.酸性KMnO4溶液中通入SO2,离子方程式:5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+,故B正确;
C.FeBr2溶液中通入足量Cl2,离子方程式:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl-,故C错误;
D.AgCl悬浊液中通HI,离子方程式:AgCl+I-═AgI↓+Cl-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,侧重考查氧化还原反应、复分解反应的离子方程式书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式的拆分,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | NH4Cl | B. | Mg(HCO3)2 | C. | H2SO4 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )
),碳酸亚乙酯可由两种分子发生酯化反应制取,这两种分子的原子个数比为( )| A. | 3:5 | B. | 1:2 | C. | 2:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.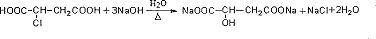 .
. 等.(任写一种)
等.(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
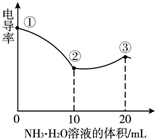 电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )
电导率可用于衡量电解质溶液导电能力大小,且电导率越大溶液的导电能力越强.室温下,用0.100mol/L的NH3•H2O 滴定10.00mL 浓度均为0.100mol/LHCl和CH3COOH的混合液,电导率曲线如右图所示.下列说法正确的是( )| A. | ①点溶液中c(H+)为0.200 mol/L | B. | ②点时溶液的温度最低 | ||
| C. | ③点后离子数目减少电导率略降低 | D. | ③点时溶液中有c ( Cl-)>(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
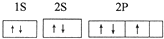
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 记载中的反应属于置换反应 | B. | 记载中蕴含了湿法炼铜的原理 | ||
| C. | 由记载得出铁单质是赤色(红色) | D. | 每生成1mol铜转移2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 目的 | 装置 | 原理 |
| A | 分离乙酸乙酯和乙醇 |  | 乙酸乙酯和乙醇的密度不同 |
| B | 实验室制备氨气 |  | 2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3+2H2O |
| C | 证明非金属性N>C>Si |  | 最高价含氧酸酸性:硝酸>碳酸>硅酸 |
| D | 除去丁醇中的乙醚 |  | 丁醇和乙醚的沸点不同 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com