
����Ŀ���±��а���������(1��2��)��Ԫ�����ڱ����л��е���š������Ԫ��A��I�����ڱ��е�λ�ã��ش��������⡣
1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 | |
1 | A | |||||||
2 | B | C | D | E | ||||
3 | F | G | H | I |
(1)B��C��Ԫ���зǽ����Խ�ǿ����________(д��Ԫ������)��IԪ�������ڱ��е�λ����__________��
(2)����ijԪ�����γ����������д������������������������Һ�����ӷ�Ӧ����ʽ_________��
(3)����ijԪ�صĵ����ڳ�����Ϊ��̬����Ԫ������A��I�е�һ��Ԫ�ع���ԭ�Ӹ�����Ϊ1��1��1��2�����ֹ��ۻ�����X��Y����д��Y�ĵ���ʽ_________����Ԫ�ػ�����A��I�е���һ��Ԫ����ԭ�Ӹ���֮��Ϊ1��1��1��2�γ��������ӻ�����Z��M���õ���ʽ��ʾM���γɹ��̣�____��
(4)����ij����Ԫ�ص���̬���ʿ����γ�ȼ�ϵ�أ�������������Ⱦ����д�����Ի����и�����Ӧʽ____��
���𰸡��� �������ڵڢ�A�� Al2O3��2OH��=2AlO2-��H2O ![]()
![]() H2-2e-+2OH-= 2H2O(�� 2H2-4e-+4OH-=4H2O )
H2-2e-+2OH-= 2H2O(�� 2H2-4e-+4OH-=4H2O )
��������
��Ԫ�������ڱ��е�λ�ÿ�֪��AΪ��Ԫ�أ�BΪ̼Ԫ�أ�CΪ��Ԫ�أ�DΪ��Ԫ�أ�EΪ��Ԫ�أ�FΪ��Ԫ�أ�GΪ��Ԫ�أ�HΪ��Ԫ�أ�IΪ��Ԫ�ء�
(1)ͬ����������ң��ǽ�������ǿ�����Էǽ���N��C��I���ڵ����У���17�У�ΪClԪ�أ��������ڱ��е������ڣ���VIIA�壻
(2)��Ԫ��Ϊ��Ԫ�أ����γ�����������Al2O3�����������������Ʒ�Ӧ����ƫ��������ˮ�����ӷ���ʽΪAl2O3��2OH��=2AlO2-��H2O��
(3)��Ԫ�صĵ����ڳ�����Ϊ��̬����ΪH��N��O��F��Cl�е�һ�֣���������A��I����ԭ�Ӹ�����Ϊ1��1��1��2�����ֹ��ۻ������Ԫ��ֻ��O����XΪH2O2��YΪH2O��ˮΪ���ۻ��������ʽΪ![]() ������Na�γ����ӻ�����Na2O2��Na2O����MΪNa2O�����γɹ���Ϊ��
������Na�γ����ӻ�����Na2O2��Na2O����MΪNa2O�����γɹ���Ϊ��![]() ��
��
(4)���������������γ�����ȼ�ϵ�أ�ԭ����и�������������Ӧ�����������ڸ����õ��ӣ����ڵ������ҺΪ���ԣ���������ˮ���缫����ʽΪ��H2-2e-+2OH-= 2H2O(��2H2-4e-+4OH-=4H2O)��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ҫ��ش��������⣺
�ٸɱ���CO2�� �ڰ�������ף� ��![]() Cl��
Cl��![]() Cl��
Cl��
��Һ������ˮ�� ��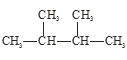 ��
�� ��
��
����������������
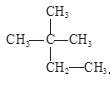
(1)��Ϊͬλ�ص���_____________��
(2)��Ϊͬ�����������__________��
(3)��Ϊͬ���칹�����_________��
(4)����ͬ�����ʵ���_________��������ţ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��X(g)+2Y(g)![]() 3Z(g) ��H=��a kJ.mol��1(a>0)������˵������ȷ����
3Z(g) ��H=��a kJ.mol��1(a>0)������˵������ȷ����
A. ���߷�Ӧ�¶ȣ��淴Ӧ������������Ӧ��������
B. �ﵽ��ѧƽ��״̬ʱ��X��Y��Z���������ٷ����仯
C. �ﵽ��ѧƽ��״̬ʱ����Ӧ�ų����������ɴ�akJ
D. X��Y��ַ�Ӧ����Z�����ʵ��������ܴﵽ3 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�����ڳ�����pH=2��H2C2O4��Һ������˵����ȷ���ǣ� ��
A. 1L��Һ�е�H+��ĿΪ0.02NA
B. ����NaHC2O4���壬��Һ������ǿ
C. c��H+��-c��OH-��=c��HC2O4-��+2c��C2O42-��
D. ��ˮϡ�ͣ���Һ����������Ũ�Ⱦ���С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���������ѧ��ѧ�г��������ʣ���Ϊ�����������ʣ���Ϊ����ɫ�ĵ������壬�ҡ����dz�����ɫ��̬�ǽ������ʣ�������Ϊ�����C������Ϊһ��Һ�壬B��D�ֱ�Ϊ��ɫ��ĩ�ͺ�ɫ���壬GΪ����ɫ���壬JΪ�����г����ĵ�ζƷ��IΪ���ɫ���壬FΪ�ػ�ɫ��Һ������ʵ������ȡ���ķ�Ӧ֮һ�������ʼ��ת������ͼ��ʾ���ش���������(����������δ�г�)��

(1)����I�Ļ�ѧʽΪ________��F����������______________��
(2)��Ӧ�ٵĻ�ѧ����ʽΪΪ____________��
(3)B��K�ķ�Ӧ��ʵ������ȡ���ķ�Ӧ�������ӷ���ʽΪ____________��
(4)��Ӧ�ڵĻ�ѧ����ʽΪ_____________��
(5)��E��G�����ʵ�����Ϊ1:1Ͷ������ˮ�У���Ӧ�Ļ�ѧ����ʽΪ_________������1mol����ת�Ƶ��ӵĸ���Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������أ�K2FeO4����һ�����͡���Ч�������ɫˮ����������Cl2��O2��ClO2��KMnO4�����Ը�ǿ��������Ⱦ����ҵ�������Ƶø������ƣ�Ȼ���ڵ����£������������Һ�м���KOH�����ͣ�ʹ�������������
��1���ɷ��Ʊ��������Ƶ���Ҫ��ӦΪ2FeSO4+6Na2O2�T2Na2FeO4+2Na2O+2Na2SO4+O2�����÷�Ӧ�еĻ�ԭ����____��ÿ����l mol Na2FeO4ת��__mol���ӡ�
��2��ʪ���Ʊ�������أ�K2FeO4���ķ�Ӧ��ϵ������������Fe��OH��3��ClO����OH����FeO42����Cl����H2O��
��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��________��
������Ӧ������ת����0.3mol���ӣ���ԭ��������ʵ���Ϊ______mol��
��3����SO2ͨ�뺬1mol�������Һ�У�������һ��ǿ���һ�����������6.02��1023������ת�ƣ���÷�Ӧ�Ļ�ѧ����ʽΪ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ���ܺ���Cl����SO42����CO32����NH4+��Fe3+��Fe2+��Al3+ ��Na+��ijͬѧΪ��ȷ����ɷ֣�ȡ������Һ����Ʋ����������ʵ�飺

�ɴ˿�֪ԭ��Һ��
A��ԭ��Һ��c��Fe3+��=0.2 mol��L-1
B����Һ��������4�����Ӵ��ڣ�����Cl��һ�����ڣ���c��Cl������0.2 mol��L-1
C��SO42����NH4+ ��Na+һ�����ڣ�CO32����Al3+һ��������
D��Ҫȷ��ԭ��Һ���Ƿ���Fe2+,�����Ϊ��ȡ����ԭ��Һ���Թ���,����������ˮ���������ټ�KSCN��Һ����Һ��Ѫ��ɫ������Fe2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ����Ŀǰ����о����ȵ�֮һ��ij����С�����Ƶ�����ȼ�ϵ����ͼ��ʾ��a��b��Ϊ���Ե缫������������ȷ����( )
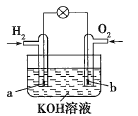
A.a���Ǹ������õ缫�Ϸ���������Ӧ
B.b�������ĵ缫��Ӧ��O2+4OH--4e-=2H2O
C.����ܷ�Ӧ����ʽΪ2H2+O2=2H2O
D.����ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼԭ��ص�����������ǣ� ��

A.��ع���ʱ�������� a ���� b
B.�������ڵ缫���ŵ�ʱ����������Ӧ
C.�ŵ�����У�H����������������
D.������ӦʽΪ��MnO2��4H����2e��=Mn2����2H2O
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com