
【题目】乙烯是基本的有机化工原料。用乙烯和常见的有机物可合成一种醚类香料和一种缩醛类香料,具体合成路线如图所示(部分反应条件略去):

已知:![]()
![]() 2ROH+
2ROH+![]() ,回答下列问题
,回答下列问题
(1)![]() 的结构简式为_______,
的结构简式为_______,![]() 中官能团名称为__________。
中官能团名称为__________。
(2)若![]() 为单取代芳香族化合物且能与金属钠反应;毎个
为单取代芳香族化合物且能与金属钠反应;毎个![]() 分子中只含有1个氧原子,
分子中只含有1个氧原子,![]() 中氧元紫的质量分数约为13.1%,则⑥的反应类型是__________。
中氧元紫的质量分数约为13.1%,则⑥的反应类型是__________。
(3)写出苯乙醛与新的银氨溶液反应的化学方程式:________________。
(4)请写出满足下列条件的苯乙醛的所有同分异构体的结构简式:_____________。
i.含有苯环和![]() 结构
结构
ii.核磁共振氢谱有4组峰,且峰面积之比为3:2:2:1
(5)若化合物![]() 为苯甲醚的同系物,且相对分子质量比苯甲醚大28,则能使
为苯甲醚的同系物,且相对分子质量比苯甲醚大28,则能使![]() 溶液显色的
溶液显色的![]() 的所有同分异构体共有________(不考虑立体异构)种。
的所有同分异构体共有________(不考虑立体异构)种。
(6)参照题中的合成路线,由2-氯丙烷经如下步骤制 。写出
。写出![]() 的反应条件___________,
的反应条件___________,![]() 的结构简式___________,_________________。
的结构简式___________,_________________。
【答案】 羟基 氧化反应
羟基 氧化反应 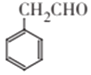 +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
 +2Ag↓+3NH3+H2O
+2Ag↓+3NH3+H2O 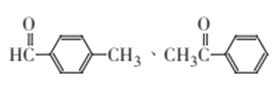 9 氢氧化钠的醇溶液,加热
9 氢氧化钠的醇溶液,加热 ![]()
【解析】
乙烯在Ag和O2的条件下,被氧化成 ,则A为
,则A为 ,与CO2反应生成
,与CO2反应生成 ,再和B反应根据已知:
,再和B反应根据已知: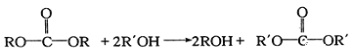 生成
生成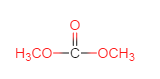 和C物质,可推断出B为
和C物质,可推断出B为![]() ,C为
,C为![]() ,从反应④也可推出B为
,从反应④也可推出B为![]() ,D物质被CrO3氧化成
,D物质被CrO3氧化成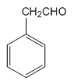 ,再结合反应⑤可推出D物质为
,再结合反应⑤可推出D物质为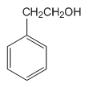 ,据此作答。
,据此作答。
根据上述分析可知,
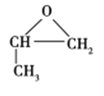
(1)![]() 为环氧乙烷,其结构简式为
为环氧乙烷,其结构简式为 ,
,![]() 为甲醇,其官能团名称为羟基,故答案为:
为甲醇,其官能团名称为羟基,故答案为: ;羟基;
;羟基;
(2)D能与金属钠反应,且D分子中只有一个氧原子,即D中含有-OH,D属于芳香族化合物,即D中含有苯环,D的相对分子质量为1×16/13.1%=122,即D为苯甲醇,环氧乙烷与苯在AlCl3作用下发生反应生成苯甲醇,苯甲醇被氧化成苯甲醛,即反应⑥为氧化反应,故答案为:氧化反应;
(3)苯乙醛与新的银氨溶液发生银镜反应,其化学方程式: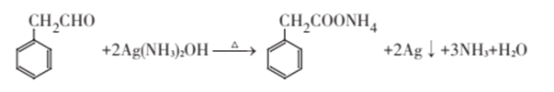 ,故答案为:
,故答案为: ;
;
(4)核磁共振氢谱有4组峰,且峰面积之比为3 : 2 : 2 : 1,说明含有四种不同环境的氢,故取代后的苯环应是对称的结构,符合条件的结构简式为 ![]() 、
、![]() ,故答案为:
,故答案为: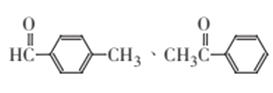 ;
;
(5)若化合物E为苯甲醚的同系物,且相对分子质量比苯甲醚大14,则能使FeCl3溶液显色,可推出化合物E比苯甲醚多一个CH2,且含有一个酚羟基,则取代基在苯环上有两种情况,一种是酚羟基和乙基,另一种是酚羟基和两个甲基,同分异构体如图所示: 此类型有3种;采用“定一议二”思路可知,
此类型有3种;采用“定一议二”思路可知,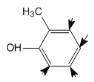 ,此类型有4种;
,此类型有4种; ,此类型有2种,总共3+4+2=9种,故答案为:9;
,此类型有2种,总共3+4+2=9种,故答案为:9;
(6)根据反应②,推出生成目标物原料是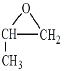 ,根据路线①,用乙烯与O2在Ag作催化剂的条件下生成环氧乙烷,因此生成
,根据路线①,用乙烯与O2在Ag作催化剂的条件下生成环氧乙烷,因此生成 的原料是CH3CH=CH2,生成丙烯,用2-丙烷发生消去反应,合成路线为
的原料是CH3CH=CH2,生成丙烯,用2-丙烷发生消去反应,合成路线为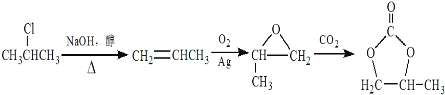 ,故答案为:氢氧化钠的醇溶液,加热;
,故答案为:氢氧化钠的醇溶液,加热;![]() ;
; 。
。


科目:高中化学 来源: 题型:
【题目】氟化钙材料具有良好的透光性和较低的折射率,可用做紫外和红外光学元件、不可见光谱范围内的消色差镜头。如图为氟化钙晶胞,其中小球代表Ca2+,大球代表F-。
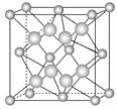
(1)每个晶胞实际含有________个Ca2+和________个F-。
(2)氟化钙晶体可以看作Ca2+按__________堆积排列,F-填入Ca2+堆积的部分空隙中。每个Ca2+周围有__________个F-,而每个F-周围有_________个Ca2+,每个F-周围与其距离最近的F-的数目是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表第________族。
(2)目前,国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度淡水。由此可判断蒸馏法是________________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式:食盐+H2O―→NaOH+H2↑+Cl2↑(未配平),该反应中食盐的化学式是________________________;利用电解所得气体制36.5%的浓盐酸1 000 t,最少需消耗食盐________ t。
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下:

请写出②④的化学反应方程式:______,________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是

A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某配位化合物为深蓝色晶体,由原子序数由小到大的A,B,C,D,E五种元素组成,其原子个数比为14∶4∶5∶1∶1。其中C,D同主族且原子序数D为C的2倍,E元素的外围电子排布式为(n-1)dn+6ns1,试回答下列问题:
(1)元素B,C,D的第一电离能由大到小排列顺序为________(用元素符号表示)。
(2)D元素基态原子的最外层电子排布图为________。
(3)该配位化合物的化学式为________,配体的中心原子的杂化方式为________。
(4)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1∶1和1∶2,两种化合物可以任意比互溶,解释其主要原因为_______________。
(5)A元素与B元素可形成分子式为B2A2的某化合物,该化合物的分子具有平面结构,则其结构式为________,分子中含有________个σ键,________个π键。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验: ①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;
②向滤液b中滴加几滴0.1molL﹣1KI溶液,出现浑浊;
③向沉淀c中滴加几滴0.1molL﹣1KI溶液,沉淀变为黄色.
下列分析不正确的是
A. 浊液a中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl﹣(aq)
Ag+(aq)+Cl﹣(aq)
B. ③中颜色变化说明AgCl转化为AgI
C. 实验可以证明AgI比AgCl更难溶
D. 滤液b中不含有Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA表示阿伏加德罗常数,则关于热化学方程式:
C2H2(g)+![]() O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
A. 当有6 NA个电子转移时,该反应放出1300 kJ的能量
B. 当有1NA个水分子生成且为液体时,吸收1300 kJ的能量
C. 当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①C(s)+O2(g)![]() CO2(g) ΔH=-393.5kJ/mol
CO2(g) ΔH=-393.5kJ/mol
②2H2(g)+O2(g)![]() 2H2O(1) ΔH=-571.6kJ/mol
2H2O(1) ΔH=-571.6kJ/mol
现在0.2mol炭粉和氢气组成的悬浮气,在氧气中完全燃烧,共放出67.93kJ的热量,则混合物中C与H2物质的量之比为
A.1︰1 B.1︰2 C.2︰3 D.3︰2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
A(C3H6)是基本有机化工原料,由A制备聚合物C和 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。

已知:
(1)A的名称是____;B中含氧官能团名称是____。
(2)C的结构简式____;D-E的反应类型为____。
(3)E-F的化学方程式为____。
(4)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是____(写出结构简式)。
(5)等物质的量的 分别与足量NaOH、NaHCO3反应,消耗NaOH、NaHCO3的物质的量之比为____;检验
分别与足量NaOH、NaHCO3反应,消耗NaOH、NaHCO3的物质的量之比为____;检验 其中一种官能团的方法是____(写出官能团名称、对应试剂及现象)。
其中一种官能团的方法是____(写出官能团名称、对应试剂及现象)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com