
【题目】向含有1molHNO3和1molH2OS4的混合溶液中逐渐加入铁粉至过量,溶液中金属阳离a、b与所加铁粉的物质的量的关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断不正确的是()
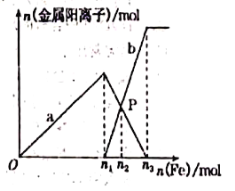
A. a表示n(Fe3+)的变化曲线
B. n1=0.75
C. P点时,n(Fe2+)=0.5625 mol
D. 向P点溶液中加入铜粉,最多可溶解14.4g
【答案】C
【解析】
试题A.向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,有效发生反应:Fe+4H++NO3-═Fe3++NO↑+2H2O,铁过量后是2Fe3++Fe=3Fe2+,a是表示Fe3+的关系曲线,A项正确;B.向含有1molHNO3和1molH2SO4的混合溶液中逐渐加入铁粉至过量,先是和H+以及NO3-反应,NO3-能将Fe氧化为Fe3+,自身还原为NO,方程式为Fe+4H++NO3-═Fe3++NO↑+2H2O,1molHNO3和1molH2SO4共有3moLH+,1mol的NO3-完全氧化需要4molH+,H+离子完全消耗,产生Fe3+离子为3/4mol,即n1=0.75mol,B项正确;C.当铁过量,会有:2Fe3++Fe=3Fe2+,设Fe3+被还原x mol, 2Fe3++Fe=3Fe2+,
2 3
x 1.5x
n2点时候Fe3+和Fe2+的物质的量相同,即0.75-x=1.5x,x=0.3,此时Fe3+的为0.45,所以p点时,n(Fe2+)=0.45mol,C项错误;D.向P点溶液中加Cu:2Fe3++Cu=3Fe2++Cu2+,设加入铜的质量是y,
2 64
0.45 y
解得y=14.4,即最多可溶解14.4gCu粉,D项正确;答案选C。


科目:高中化学 来源: 题型:
【题目】近日,中国科学院深圳先进技术研究院研发出一种高性能的钙离子电池:以溶有六氟磷酸钙Ca(PF6)2的碳酸酯类溶剂为电解液,放电时合金Ca7Sn6发生去合金化反应,阴离子(PF6)从石墨烯中脱嵌,进入电解质溶液。放电时其工作原理如下图,下列说法错误的是(已知:比能量为单位质量的电极放出电能的大小)
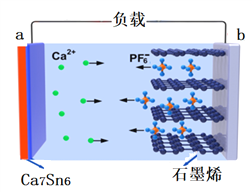
A. 电池放电时,化学能转化为电能和热能
B. 放电时,a电极的电极反应方程式为:Ca7Sn6 —14e- =7Ca2+ + 6Sn
C. 充电时,b电极接电源的正极
D. 与锂离子电池相比较钙离子电池具有材料储量丰富、比能量高的优点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔能够导电,下列关于聚乙炔![]() 和聚合物A
和聚合物A![]() 的说法中正确的是
的说法中正确的是
A. 聚合物A和聚乙炔均能使溴水褪色
B. 两种聚合物的单体互为同系物
C. 聚合物A的相对分子质量是聚乙炔的两倍
D. 1mol 两种聚合物的单体分别与Br2发生反应,最多消耗Br2的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2可通过二氧化碳甲烷化再利用。
请回答:
(1)已知:2Al2O3(s)===4Al(g)+3O2(g) ΔH1=3 351 kJ·mol-1
2C(s)+O2(g)===2CO(g) ΔH2=-221 kJ·mol-1
2Al(g)+N2(g)===2AlN(s) ΔH3=-318 kJ·mol-1
碳热还原Al2O3合成AlN的总热化学方程式是________________________,
该反应自发进行的条件________。
(2)在常压、Ru/TiO2催化下,CO2和H2混合气体(体积比1∶4,总物质的量a mol)进行反应,测得CO2转化率、CH4和CO选择性随温度变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4或CO的百分比)。
反应Ⅰ CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) ΔH4
CH4(g)+2H2O(g) ΔH4
反应Ⅱ CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH5
CO(g)+H2O(g) ΔH5
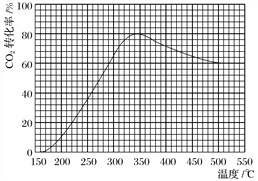
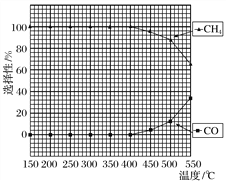
图1 图2
①下列说法不正确的是________。
A.ΔH4小于零
B.温度可影响产物的选择性
C.CO2平衡转化率随温度升高先增大后减少
D.其他条件不变,将CO2和H2的初始体积比改变为1∶3,可提高CO2平衡转化率
②350 ℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器体积为V L,该温度下反应Ⅰ的平衡常数为________(用a、V表示)。
③350 ℃下CH4物质的量随时间的变化曲线如图3所示。画出400 ℃下0~t1时刻CH4物质的量随时间的变化曲线。__________________________
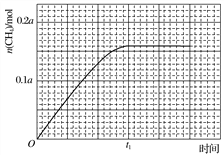
图3
(3)据文献报道,CO2可以在碱性水溶液中电解生成甲烷,生成甲烷的电极反应式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含有Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol L-1的HC1溶液,测得溶液中某几种离子的物质的量的变化情况如图所示。下列说法不正确的是

A. b和c曲线表示的离子反应均为CO32-+H+= HCO3-
B. 结合H+的能力:AlO2->CO32-> HCO3->Al(OH)3
C. M点时A1(OH)3的质量等于3.9 g
D. 原混合溶液中,CO32-与AlO2-的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二甲醚又称甲醚,简称DME,熔点为-141.5℃,沸点为-24.9℃。二甲醚与液化石油气(LPG)相似,被誉为“21世纪的清洁燃料”。由合成气(CO、H2)制备二甲醚的反应原理如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1= -90.0 kJ·mol-1
CH3OH(g) △H1= -90.0 kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
CH3OCH3(g)+H2O(g) △H2=-20.0kJ·mol-l
回答下列问题:
(1)反应①为熵___________(填“增加”或“减少”)的反应,__________ (填“低温”或“高温”)下易自发进行。
(2)写出由合成气(CO、H2) 直接制备二甲醚的热化学方程式:__________________________________。
(3)温度为500K时,在2L的密闭容器中充入2 mol CO和6 molH2发生反应①、②,5 min时达到平衡,平衡时CO的转化率为60%,c(CH3OCH3)=0.2 mol·L-1,用H2表示反应①的速率是______________,反应②的平衡常数K=________________。
若在500K时,测得容器中n(CH3OCH3)=2n (CH3OH),此时反应②的v正__ v逆(填“>”、 “< ”或“=”)。
(4)研究发现,在体积相同的容器中加入物质的量相同的CO和H2发生反应①、②,在不同温度和有无催化剂组合下经过相同反应时间测得如下实验数据:
T(K) | 催化剂 | CO转化率(%) | CH3OCH3选择性(%) |
473 | 无 | 10 | 36 |
500 | 无 | 12 | 39 |
500 | Cu/ZnO | 20 | 81 |
[备注]二甲醚选择性:转化的CO中生成CH3OCH3的百分比
①相同温度下,选用Cu/ZnO作催化剂,该催化剂能____________ (填标号)。
A.促进平衡正向移动 B.提高反应速率 C.降低反应的活化能
D.改变反应的焓变 E.提高CO的平衡转化率
②表中实验数据表明,在500K时,催化剂Cu/ZnO对CO转化成CH3OCH3的选择性有显著的影响,其原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与含氯化合物有关的说法正确的是
A. HClO是弱酸,所以NaClO是弱电解质
B. 向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
C. 六水合氯化钙可用作食品干燥剂
D. 氯化铵、漂白粉都属于强电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是![]() ,以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
,以互为同系物的单取代芳香烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
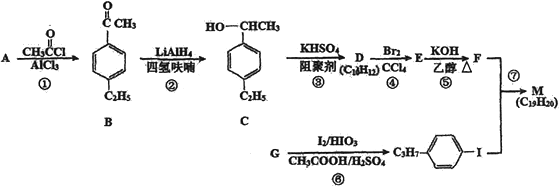
回答下列问题:
(1)A的结构简式为________________, B中的官能团名称是____________________。
(2)②的反应类型是_______________,F的名称为____________________。
(3)写出由C生成B的化学方程式______________________________________。
(4)反应⑤的化学方程式是______________________________________。
(5)B的同分异构体中满足苯环上有两个取代基且能发生银镜反应共有________种(不含立体异构);B的另一种同分异构体中,除苯环外还有一个环,其核磁共振氢谱为4组峰,且峰面积比为2:2:1:1,该同分异构体的结构简式为__________________。
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成___。
的合成___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A. 溶解烧渣选用足量硫酸,试剂X选用铁粉
B. 固体1中一定含有SiO2;控制pH是为了使Al3+转化为A1(OH)3进入固体2
C. 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com