
| A. | NaHCO3 溶液中:c(H+)+c(H2CO3)═c(CO32-)+c(OH-) | |
| B. | 0.1 mol/L醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后的溶液中:c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | |
| C. | 物质的量浓度相等的①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2三种溶液中,c(NH4+) 由大到小的顺序为③>②>① | |
| D. | 浓度均为0.1 mol/L的①氨水、②NaOH溶液、③Na2CO3溶液、④NaHCO3溶液,pH的大小顺序;②>③>④>① |
分析 A.根据碳酸氢钠溶液中的电荷守恒和物料守恒判断;
B.反应后溶质为等浓度的CH3COOH、CH3COONa、NaCl,醋酸的电离程度较小,则c(CH3COOH)>c(H+);
C.①NH4Cl、②(NH4)2SO4、③NH4Al(SO4)2先不考虑水解,则(NH4)2SO4含有两个NH4+,所以它们NH4+的浓度大于其它2种物质,铝离子水解呈酸性抑制了铵根离子的水解;
D.四种溶液都呈碱性,强碱溶液的pH大于弱碱,强碱弱酸盐溶液中,弱酸根离子的水解程度越大碱性越强,据此比较各溶液的pH.
解答 解:A.根据物料守恒得:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),根据电荷守恒得c(Na+)+c(H+)=2c(CO32-)+c(OH-)+c(HCO3-),二者结合可得:c(H+)+c(H2CO3)═c(CO32-)+c(OH-),故A正确;
B.0.1 mol/L醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合,反应后溶质为等浓度的CH3COOH、CH3COONa、NaCl,醋酸的电离程度较小,则c(CH3COOH)>c(H+),溶液中正确的离子浓度大小为:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),故B错误;
C.先不考虑水解,则(NH4)2SO4 中含有两个NH4+,所以它们NH4+的浓度大于其它2种物质;NH4Al(SO4)2溶液中铝离子水解呈酸性,抑制了铵根离子的水解,其溶液中c(NH4+)大于NH4Cl,溶液中c(NH4+) 由大到小的顺序为②>③>①,故C错误;
D.浓度均为0.1 mol/L的①氨水、②NaOH溶液、③Na2CO3溶液、④NaHCO3溶液,①②为碱溶液,②为强电解质,则pH②>①;③④为强碱弱酸盐,③的水解程度较大,则溶液的pH③>④,所以溶液pH的大小顺序为:②>①>③>④,故D错误;
故选A.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、电荷守恒和物料守恒的应用、溶液酸碱性与溶液pH大小比较等知识,明确电荷守恒、物料守恒及质子守恒的含义为解答关键,试题培养了学生的分析、理解能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
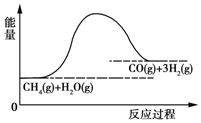 合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )
合成氨用的H2可以CH4为原料制得:CH4(g)+H2O(g)═CO(g)+3H2(g).反应过程的能量变化如图所示,关于该反应的下列说法中,正确的是( )| A. | △H<0,△S<0 | B. | △H>0,△S<0 | C. | △H<0,△S>0 | D. | △H>0,△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量浓度相等的盐酸和氨水等体积混合,所得溶液的pH<7 | |
| B. | 物质的量浓度相等的硫酸和氨水等体积混合,所得溶液的pH<7 | |
| C. | pH=3的盐酸和pH=11的氨水等体积混合,所得溶液的pH>7 | |
| D. | pH=3的硫酸和pH=11的氨水等体积混合,所得溶液的pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 混合气体通过盛水的洗气瓶 | |
| D. | 混合气体与氢气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验及现象 | 结论 |
| A | 将湿润红色石蕊试纸靠近试管口 | 反应中有NH3产生 |
| B | 收集产生的气体并点燃,火焰呈淡蓝色 | 反应中有H2产生 |
| C | 收集气体的同时测得溶液的pH为8.0 | 生成Mg(OH)2使溶液呈弱碱性 |
| D | 向NH4Cl溶液中加锌,也有大量气泡产生 | 活泼金属可促进NH4+水解 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com