
 ;写出A分子中官能团的名称羧基、羟基;
;写出A分子中官能团的名称羧基、羟基;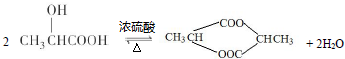 ;
;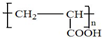 .
. 分析 有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90,9.0gA的物质的量=$\frac{9g}{90g/mol}$=0.1mol,浓硫酸增重5.4g为生成水的质量,则n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g为生成CO2的质量,则n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,所以n(C)=0.3mol,n(A):n(C):n(H)=0.1mol:0.3mol:0.6mol=1:3:6,则有机物中碳原子个数是3,氢原子个数是6,根据相对分子质量是90,所以氧原子个数=$\frac{90-12×3-6}{16}$=3,即A分子式为:C3H6O3,9.0gA和碳酸氢钠反应说明A中含有羧基,生成n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以含有一个羧基,9gA与足量金属钠反应则生成n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,所以A的结构简式为: .
.
解答 解:有机物质的密度是相同条件下H2的45倍,所以有机物质的相对分子质量=45×2=90,9.0gA的物质的量=$\frac{9g}{90g/mol}$=0.1mol,浓硫酸增重5.4g为生成水的质量,则n(H2O)=$\frac{5.4g}{18g/mol}$=0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g为生成CO2的质量,则n(CO2)=$\frac{13.2g}{44g/mol}$=0.3mol,所以n(C)=0.3mol,n(A):n(C):n(H)=0.1mol:0.3mol:0.6mol=1:3:6,则有机物中碳原子个数是3,氢原子个数是6,根据相对分子质量是90,所以氧原子个数=$\frac{90-12×3-6}{16}$=3,即A分子式为:C3H6O3,9.0gA和碳酸氢钠反应说明A中含有羧基,生成n(CO2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,所以含有一个羧基,9gA与足量金属钠反应则生成n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,羧基或羟基的物质的量与氢气的物质的量之比为2:1,A与钠反应时A的物质的量与氢气的物质的量之比是1:1,则说明A中除了含有一个羧基外还含有一个羟基,根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效氢原子,且氢原子的个数比是3:1:1:1,所以A的结构简式为: .
.
(1)A的分子结构简式为: ,含有的官能团为羧基、羟基,
,含有的官能团为羧基、羟基,
故答案为: ;羧基、羟基;
;羧基、羟基;
(2)A的系统命名是:2-羟基丙酸,故答案为:2-羟基丙酸;
(3)A可在浓硫酸催化下生成一种六元环酯,该反应的化学方程式: ,
,
故答案为: ;
;
(4)A的一种同分异构体B与A具有相同的官能团,则B为HOCH2CH2COOH,B发生消去反应生成C为CH2=CHCOOH,C发生加聚反应高分子化合物D为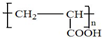 ,故答案为:
,故答案为: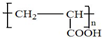 .
.
点评 本题是一道关于有机物的结构和性质知识的综合推断题,属于计算型推断,考查学生对知识的整合能力,难度中等,注意根据A和碳酸氢钠、钠反应时生成气体体积判断含有的官能团.


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 生石灰和水 | B. | 熟石灰和水 | C. | 浓硫酸和水 | D. | 氯化钠和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子数和气体质量均不同 | B. | 分子数和中子数均相同 | ||
| C. | 质子数和中子数均相同 | D. | 分子数、原子数和质子数均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验事实 | 理论解释 |
| A | N原子的第一电离能大于O原子 | N原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C=O之间的夹角为120° |
| C | H2O的沸点大于H2S的沸点 | H2O是液态的,H2S是气态的 |
| D | HF比HCl稳定 | HF分子间可以形成氢键 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL四氯化碳和3mL水 ③1mL乙酸和3mL水.图中三支试管从左到右的排列顺序为( )
在3支试管中分别放有:①1mL乙酸乙酯和3mL水 ②1mL四氯化碳和3mL水 ③1mL乙酸和3mL水.图中三支试管从左到右的排列顺序为( )| A. | ①②③ | B. | ①③② | C. | ②①③ | D. | ②③① |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
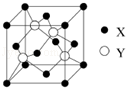 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:B>A,离子半径:C<D | |
| B. | B的单质能与A的最高价氧化物发生置换反应 | |
| C. | 元素B和D能形成BD2型的共价化合物 | |
| D. | D的单质有毒,且有漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com