
【题目】用98%的浓硫酸(其密度为1.84g·cm-3)配制250mL0.4mol·L-1稀硫酸,有以下实验仪器供选:
A.10mL量筒 B.托盘天平 C.玻璃棒 D.250mL容量瓶 E.500mL容量瓶 F.胶头滴管 G.烧杯
(1)需量取浓硫酸的体积为___mL。
(2)实验时不可选用的仪器有(填序号)___。
(3)配制过程中,下列情况会使配制结果偏高的是___(填序号)
①容量瓶使用时未干燥;
②定容时俯视刻度线观察液面;
③将浓硫酸在烧杯中稀释后未经冷却就转移至容量瓶中,并定容;
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(4)配制过程中,实验操作步骤为:___
A.在烧杯中注入蒸馏水(溶液体积少于250mL),沿烧杯壁注入量取的浓硫酸用玻璃棒搅拌,使其混匀。
B.待稀释的硫酸冷却后,沿玻璃棒注入250mL的容量瓶中
C.用量筒量取密度为1.84g/cm3质量分数为98%的浓硫酸
D.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
E.往容量瓶中小心加蒸馏水至液面接近刻度1-2cm处,改用__加蒸馏水,使溶液凹液面恰好与刻度线相切。
【答案】5.4 BE ②③ CABDE 胶头滴管
【解析】
(1)根据稀释定律进行计算;
(2)配制溶液时需要量筒、玻璃棒、烧杯、250mL容量瓶和胶头滴管;
(3)根据错误的操作,利用c=![]() 进行分析;
进行分析;
(4)配制溶液时的过程为:将浓硫酸沿烧杯壁缓缓注入盛有水的烧杯中,用玻璃棒不断搅拌散热,冷却至室温后溶液沿玻璃棒引流入250mL的容量瓶中,洗涤烧杯和玻璃棒2-3次,并将洗涤液也注入到容量瓶中,向容量瓶中加水至距刻度线1-2cm处,改用胶头滴管滴加水,至凹液面最低点与刻度线相切,塞上瓶塞,倒转摇匀,根据配制过程为操作步骤排序。
(1)98%的浓硫酸的浓度为![]() =
=![]() =18.4mol/L,根据稀释定律c(浓)V(浓)=c(稀)V(稀)可知,V(浓)=
=18.4mol/L,根据稀释定律c(浓)V(浓)=c(稀)V(稀)可知,V(浓)=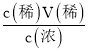 =
=![]() =0.0054L=5.4mL;
=0.0054L=5.4mL;
(2)配制溶液时需要量筒、玻璃棒、烧杯、250mL容量瓶和胶头滴管,不需要称量质量,因此不需要托盘天平,配制的溶液时250mL,因此选择250mL容量瓶,不选择500mL容量瓶;
(3)①容量瓶使用时未干燥,对实验结果没有影响,错误;
②定容时俯视刻度线观察液面,读得的液体体积偏小,导致配制的溶液浓度偏高,正确;
③将浓硫酸在烧杯中稀释后未经冷却就转移至容量瓶中,并定容,恢复到室温时,温度降低,溶液体积缩小,导致所配溶液浓度偏大,正确;
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,加入溶剂过多,使溶液浓度偏小,错误;
正确的为②③;
(4)根据分析可知,配制250mL稀硫酸的步骤为:用量筒量取密度为1.84g/cm3质量分数为98%的浓硫酸,在烧杯中注入蒸馏水(溶液体积少于250mL),沿烧杯壁注入量取的浓硫酸用玻璃棒搅拌,使其混匀,待稀释的硫酸冷却后,沿玻璃棒注入250mL的容量瓶中,用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中,往容量瓶中小心加蒸馏水至液面接近刻度1-2cm处,改用胶头滴管加蒸馏水,使溶液凹液面恰好与刻度线相切,因此步骤为CABDE。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到目的的是( )
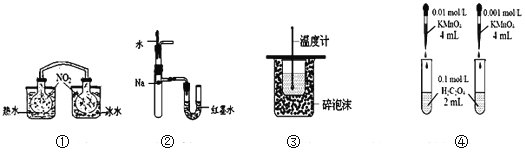
A. 装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)![]() N2O4(g)平衡移动的方向
N2O4(g)平衡移动的方向
B. 装置②依据U管两边液面的高低判断Na和水反应的热效应
C. 装置③测定中和热
D. 装置④依据褪色快慢比较浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸和硫酸镁是重要的化工原料。以硼铁混精矿[主要成分为MgBO2(OH)、UO2和Fe3O4,还有少量的Fe2O3、FeO、SiO2]为原料制备硼酸和硫酸镁的工艺流程如下:
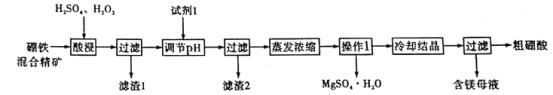
已知:①UO22+在pH为4-5的溶液中生成UO2(OH)2沉淀;②Fe2+和Fe3+沉淀完全的pH分别为9.7、3.7。
(1)酸浸过程中MgBO2(OH)与硫酸反应的离子方程式为_____。
(2)酸浸过程中加入H2O2的目的是______(写出两条),滤渣1的主要成分是___(填化学式)。
(3)试剂1最好选择_____(填化学式)。若调节溶液pH前,溶液中c(Mg2+)=0.2 mol/L,当溶液pH调至5时,UO2+沉淀完全,此时是否有Mg(OH)2沉淀生成____。{通过计算说明,Ksp[Mg(OH)2]=5.6×10-12}
(4)操作1的名称是_____。
(5)MgSO4·H2O加热脱水可以得无水MgSO4,那么MgCl2·6H2O晶体直接加热___(填“能”或“不能”)得到无水MgCl2,理由是_______。
(6)已知:H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11;H3BO3的Ka=5.8×10-10。向碳酸钠溶液里逐滴加入硼酸溶液____(填“有”或“无”)气泡产生,理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸巴氯芬是一种用于改善骨骼肌痉挛的口服片剂。下面是它的一种合成路线(具体反应条件和部分试剂略):

已知:①RCOOH![]() RCOCl
RCOCl
②H3C-CHO![]() H3C-CH=CH-COOH
H3C-CH=CH-COOH
(1)A是一种芳香烃,其分子式为____,B→C的反应类型为___。
(2)H中所含官能团的名称是______。
(3)写出F→G反应的化学方程式______。
(4)C的同分异构体中能与FeCl3溶液发生显色反应的有____种(不考虑立体异构),其中核磁共振氢谱有3种峰且峰面积之比为2:2:1的结构简式为____。
(5)由B开始制取E的合成路线有多种,请将下列合成路线中的相关内容补充完整,有机物写结构简式,无机物写分子式______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稠环芳香烃是指两个或两个以上的苯环通过共用环边所构成的多环有机化合物。常见的稠环芳香烃如萘、蒽、菲、芘等,其结构分别为
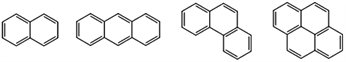
萘 蒽 菲 芘
下列说法不正确的是
A. 萘的分子式为C10H8,与H2完全加成后,产物的分子式为C10H18
B. 蒽、菲、芘的一氯代物分别有3种、5种、5种
C. 上述四种物质的分子中,所有碳原子均共平面
D. 上述四种物质均可与浓硝酸发生硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据预测,到2040年我国煤炭消费仍将占能源结构的三分之一左右。H2S在催化活性碳(AC)表面的迁移,对煤的清洁和综合应用起了很大的促进作用,其机理如图所示,其中ad表示物种的吸附状态。下列有关叙述错误的是

A.图中阴影部分表示H2S分子的吸附与离解
B.AC表面作用的温度不同,H2S的去除率不同
C.H2S在AC表面作用生成的产物有H2O、H2、S、SO2、CS2等
D.图中反应过程中只有H—S键的断裂,没有H—S键的形成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有机化学方程式书写正确的是( )
A. CH4+Cl2![]() CH2Cl2+H2
CH2Cl2+H2
B. H2C=CH2+Br2→CH3CHBr2
C. 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
D. CH3CH2OH+CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(C7H8)和二甲苯(C8H10)是重要的化工原料。利用苯(C6H6)和甲醇(CH3OH)在催化剂作用下反应得到C7H8、C8H10和副产物三甲苯(C9H12),发生的主要反应如下:
Ⅰ.C6H6(g)+CH3OH(g)C7H8(g)+H2O(g)
Ⅱ.C7H8(g)+CH3OH(g)C8H10(g)+H2O(g)
Ⅲ.C8H10(g)+CH3OH(g)C9H12(g)+H2O(g)
(1)500℃、0.18Mpa条件下,反应达到平衡时,结果如图所示。
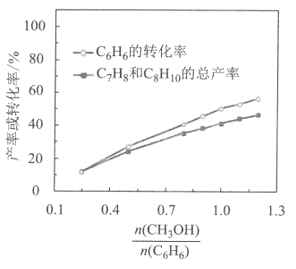
①由图分析,随着投料比![]() 增加,CH3OH的平衡转化率___,平衡时
增加,CH3OH的平衡转化率___,平衡时![]() 的值___。(填“增大”、“减小”或“不变”)
的值___。(填“增大”、“减小”或“不变”)
②投料比![]() 为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为___,反应I的平衡常数K=___。
为1.0时,C6H6的平衡转化率为50%,产物中C7H8、C8H10和C9H12物质的量之比为6︰3︰1。CH3OH的平衡转化率为___,反应I的平衡常数K=___。
(2)我国学者结合实验与计算机模拟结果,研究了反应I在固体酸(HB)催化剂表面进行的反应历程如图所示。其中吸附在固体酸(HB)表面的物种用*标注。
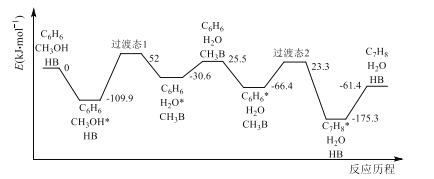
①反应I的H=___kJ·mol-1。
②吸附CH3OH的焓变___吸附C6H6的焓变(填“>”或“<”)。
③C6H6*在催化剂表面转化为C7H8*的反应方程式为___。
④在固体酸(HB)催化作用下,测得反应I的速率方程为v=kp(C6H6)(k为速率常数)。在刚性容器中发生反应I,关于反应I的平衡常数(K)和反应速率(v)的叙述正确的是__(填标号)。
A.升高温度,K和v均增大
B.增大p(C6H6),K不变,v增大
C.降低温度,K和v均减小
D.增大p(CH3OH),K不变,v增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二次电池装置如图所示,锂、充有催化剂的碳纳米管为电极,电解质能传导Li+。放电时生成的Li2CO3和C附着在电极上,充电时可使Li2CO3转化为Li、CO2和O2。下列说法不正确的是( )
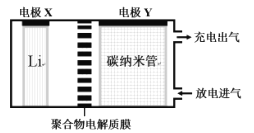
A.放电时,电流从电极Y经外电路流向电极X
B.充电时,电极X接外电源的正极发生氧化反应
C.充电时,电极Y的电极反应式为2Li2CO3-4e-=2CO2↑+O2↑+4Li+
D.应用该电池电镀铜,若析出64gCu,理论上消耗标况下33.6LCO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com