
【题目】25℃时,用0.10mol/L的氨水滴定10.0mLamol/L的盐酸,溶液的pH与氨水体积(V)的关系如图所示

已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是( )
A.a=0.10
B.N、P两点溶液中水的电离程度:N<P
C.M、N两点溶液中NH4+的物质的量之比大于1:2
D.Q点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
【答案】B
【解析】
![]() 用0.10mol/L的氨水滴定10.0mLamol/L的盐酸,N点溶液存在:c(Cl-)=c(NH4+)+c(NH3·H2O),说明N点溶质为NH4Cl,此时为滴定终点,消耗氨水的体积为
用0.10mol/L的氨水滴定10.0mLamol/L的盐酸,N点溶液存在:c(Cl-)=c(NH4+)+c(NH3·H2O),说明N点溶质为NH4Cl,此时为滴定终点,消耗氨水的体积为![]() ,二者恰好反应,则a=0.10,A正确;
,二者恰好反应,则a=0.10,A正确;
B.N点恰好生成NH4Cl,NH4+水解促进水的电离,P点时存在过量的氨水,NH3·H2O电离会抑制水的电离,则N、P两点溶液中水的电离程度:N>P,B错误;
C.M点时加入的氨水的体积为5.0mL,则溶液为NH4Cl、HCl等浓度的混合溶液,由于有HCl的存在,抑制NH4Cl的水解作用,N点时达到滴定终点,此时溶液中恰好生成NH4Cl,若不考虑水解,M、N两点溶液中NH4+的物质的量之比等于1:2,由于M点处NH4Cl被抑制,N点处NH4Cl水解不受抑制,则M、N两点溶液中NH4+的物质的量之比大于1:2,C正确;
D.Q点时加入氨水的体积为20.0mL,此时溶液为NH4Cl、NH3·H2O等浓度的混合溶液,根据物料守恒可得2c(Cl-)=c(NH4+)+c(NH3·H2O),根据电荷守恒可得:c(H+)+c(NH4+)=c(OH-)+c(Cl-),将电荷守恒式子扩大二倍,减去物料守恒式子,整理可得:2c(H+)+c(NH4+)=2c(OH-)+c(NH3·H2O),即:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O),D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】喷泉是一种常见的现象,其产生的原理是存在压强差(如图所示)。
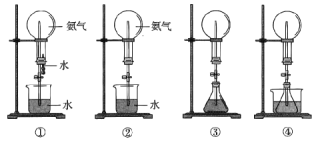
试回答下列问题:
(1)实验室制取氨气的化学方程式为_________________________________。
①用图①装置进行喷泉实验,上部烧瓶已充满干燥氨气,引发喷泉的操作是_____________。
②如果只提供图②的装置,请说明引发喷泉的方法:______________________。
(2)利用图③装置,在锥形瓶中分别加入足量的下列物质,反应后可能产生喷泉的是______。
A.Cu与稀盐酸 B.Fe和稀硫酸 C.Cu与稀硝酸 D.NaHCO3溶液与NaOH溶液
(3)在图④锥形瓶中加入酒精瓶外放一水槽,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉,水槽中加入的物质可能是___________。
A.浓硫酸 B.食盐 C.硝酸钾 D.硫酸铜
(4)同温同压下,两个等体积的干燥圆底烧瓶中分别充满NH3和NO2,进行喷泉实验,如图所示,经充分反应后,发现烧瓶①中充满液体,②中充有![]() 体积的液体,则两烧瓶内溶质的物质的量浓度的正确关系是______
体积的液体,则两烧瓶内溶质的物质的量浓度的正确关系是______
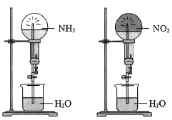
A.①>② B.①<② C.①=② D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6mol X气体和0.4mol Y气体混合于2L容器中,发生反应:3X(g)+Y(g)== nZ(g)+2W(g),5min末已生成0.2mol W,若测知以Z浓度变化来表示的平均速率为0.03mol·L﹣1·min﹣1,计算:
(1)n的值为____;
(2)前5min内用X表示的反应速率_____;
(3)5min末Y的浓度_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol·L-1,含硝酸的浓度为1 mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.224 mLB.168 mL
C.112 mLD.89.6 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的a、b两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是
的a、b两种酸溶液各1mL,分别加水稀释到1000mL,其中pH与溶液体积V的关系如图所示。下列说法正确的是![]()
![]()
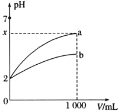
A.a、b两酸溶液的物质的量浓度一定相等
B.稀释后,a酸溶液的酸性比b酸溶液强
C.![]() 时,a是强酸,b是弱酸
时,a是强酸,b是弱酸
D.若a、b都是弱酸,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,pH=2的盐酸和醋酸各1mL分别加水稀释,pH随溶液体积变化的曲线如下图所示。下列说法不正确的是( )

A. 曲线Ⅰ代表盐酸的稀释过程 B. a溶液的导电性比c溶液的导电性强
C. a溶液中和氢氧化钠的能力强于b溶液 D. 将a、b两溶液加热至30℃, 变小
变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用 CuO 与 NH3 反应,研究 NH3 的某种性质并测定其组成, 设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
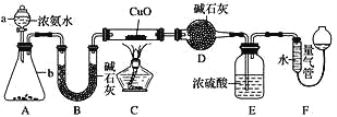
(1)仪器 a 的名称为 _____________。
(2)实验中观察到装置 C 中黑色 CuO 粉末变为红色固体,量气管有无色无味的气体,上述现象证明 NH3 具有 _____________性,写出相应的化学方程式 ____________。
(3)E 装置中浓硫酸的作用 ____________。
(4)读取气体体积前,应对装置 F 进行的操作:_____________。
(5)实验完毕,若测得干燥管 D 增重 mg,装置 F 测得气体的体积为 n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为____________(用含 m、n 字母的代数式表示)
(6)在实验室中用图中 A 装置也可制取 SO2 气体:
①选用的药品可以是 _____________。
A.Na2SO3 溶液与 HNO3 B.Na2SO3 固体与浓 H2SO4
C.碳与浓 H2SO4 D.铜与浓 H2SO4
②将制得的 SO2通入淀粉碘化钾溶液,现象为 _________,表明 SO2 的氧化性比 I2___________(填“强或“弱”)。
③实验室用 NaOH 溶液作为 SO2 的吸收剂防止污染空气,若向 100mL 0.3mol/L 的 NaOH溶液中通入标准状况下 0.448LSO2 气体,所得溶液中的溶质是_________(填化学式)。
④某硫酸厂拟用含 Cr2O72-的酸性废水处理烟气中 SO2,反应后的铬元素以 Cr3+形式存在, 则反应中氧化剂和还原剂的物质的量之比是 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。三位科学家因在锂离子电池研发领域作出的贡献而获2019年诺贝尔化学奖。完成下列填空:
(1)锂位于元素周期表的___。已知金属熔点:锂>钠>钾,请根据晶体结构理论解释原因:___。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式__,LiH中阴离子半径大于阳离子半径,其原因是___。
(3)工业上用Li2CO3制取锂的化合物及金属锂。用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:
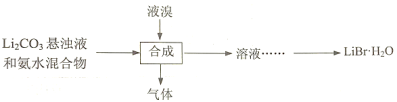
合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:____Li2CO3+____Br2+____NH3·H2O→______LiBr+______+ ______。
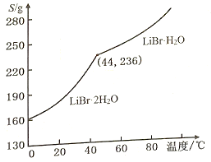
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:___、___、过滤、用乙醇洗涤,干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在含CH3COOH和CH3COO-的溶液中, CH3COOH、CH3COO-二者中各自所占的物质的量分数(a)随溶液pH变化的关系如图所示。

下列说法不正确的是
A. 在pH<4.76的溶液中,c(CH3COO-)<c(CH3COOH)
B. 在pH=7的溶液中,a(CH3COOH)=0,a(CH3COO-)=1.0
C. 在pH>4.76的溶液中,c(CH3COO-)与c(OH-)之和可大于c(H+)
D. 在pH=4.76的溶液中加盐酸,a(CH3COOH)与a(CH3COO-)之和保持不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com