
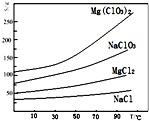
 氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室用卤块(主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质)制备少量Mg(ClO3)2•6H2O的流程如下:分析 卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入双氧水之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,可以根据溶解度受温度的影响情况来获得要制取的物质,
(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等;
(2)根据钡离子可以和硫酸根离子之间反应生成白色不溶于硝酸的白色沉淀来检验已沉淀完全;根据加氧化镁后溶液的pH为4,可以沉淀的离子来判断滤渣的主要成分;
(3)调节溶液时要注意不引入新的杂质;
(4)根据物质的溶解度大小,溶液获得晶体的方法:蒸发浓缩,趁热过滤,冷却结晶、过滤、洗涤、干燥;
(5)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则所配得的标准液浓度偏小,用去的标准液体积偏大,计算得的与K2Cr2O7标准溶液反应的Fe2+的物质的量偏大,所以与Mg(ClO3)2反应的Fe2+的物质的量偏小.
解答 解:卤块的成分有MgCl2•6H2O、MgSO4、FeCl2,加入双氧水之后,亚铁离子可以被氧化为三价铁离子,再向混合物中加入氯化钡溶液,可以将硫酸根离子转化为硫酸钡沉淀,加入氧化镁,调节pH=4,可以促进铁离子的水解,将铁离子转化为氢氧化铁而除去,过滤,得到的滤液是氯化镁,可以根据溶解度受温度的影响情况来获得要制取的物质,
(1)过滤实验用到的仪器:漏斗、玻璃棒、烧杯、滤纸、铁架台等,其中玻璃仪器有:漏斗、玻璃棒、烧杯,
故答案为:漏斗、玻璃棒、烧杯;
(2)检验硫酸根离子是否除净的方法:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全,加入氧化镁,调节溶液的pH为4,此时铁离子形成了沉淀氢氧化铁,钡离子已经和硫酸根离子只碱反应生成了硫酸钡沉淀,
故答案为:静置,取上层清液加入BaCl2,若无白色沉淀,则SO42-沉淀完全;
(3)考虑到不引入杂质,可选择MgO、Mg或MgCO3来调节溶液的pH,故答案为:①④⑥;
(4)根据物质的溶解度大小,溶液获得晶体的方法:蒸发浓缩,趁热过滤,冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩;冷却结晶;
(5)①氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
②若配制K2Cr2O7标准溶液时未洗涤烧杯,则所配得的标准液浓度偏小,用去的标准液体积偏大,计算得的与K2Cr2O7标准溶液反应的Fe2+的物质的量偏大,所以与Mg(ClO3)2反应的Fe2+的物质的量偏小,所以会导致计算出的产品中Mg(ClO3)2•6H2O的含量会偏低,
故答案为:偏低.
点评 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识;同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| D | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成苯的12个原子在同一平面上 | |
| B. | 苯环中6个碳碳键键长完全相同 | |
| C. | 苯的密度比水的小 | |
| D. | 苯只能发生取代反应,不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
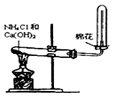 | 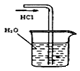 | 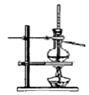 | 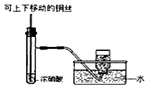 |
| A.制备少量氨气 | B.吸收HCl | C.分离苯和乙醇的混合物 | D.制备并收集少量NO2气体 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com