
下列叙述正确的是( )
A.1.00 mol NaCl中含有6.02×1023个NaCl分子
B.欲配制1.00 L 1.00 mol·L-1的NaCl溶液,可将58.5 g NaCl溶于1.00 L水中
C.1.00 mol NaCl中,所有Na+的最外层电子总数为8×6.02×1023
D.电解58.5 g 熔融的NaCl,能产生22.4 L氯气(标准状况)、23.0 g金属钠
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2016届浙江省嘉兴、杭州、宁波五校高三上第一次联考化学试卷(解析版) 题型:填空题
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3 溶液再生,其装置示意图如下:
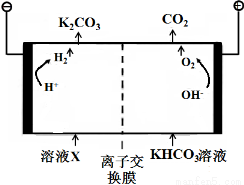
在阳极区发生的反应包括 和H ++ HCO3- === H2O + CO2↑。
简述CO32-在阴极区再生的原理 。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g) + 1/2 O2(g) === H2O(g) Δ H1= -242 kJ/mol
CH3OH(g) + 3/2 O2(g) === CO2 (g) + 2 H2O(g) Δ H2= -676 kJ/mol
① 写出CO2和H2生成气态甲醇等产物的热化学方程式 。
② 下面表示合成甲醇的反应的能量变化示意图,其中正确的是 (填字母序号)。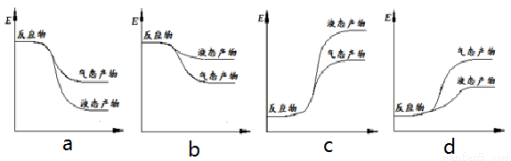
(3)在密闭的再生装置中,加入5 mol H2与2 mol CO2发生反应生成甲醇,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示,下列说法正确的是

A.P1> P2> P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1> T2> T3>T4
D.T4、P4、时,H2的平衡转化率为60%
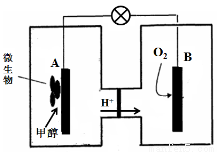
(4)已知某种甲醇燃料电池中,电解质溶液为酸性,示意图如下:工作结束后,B电极室溶液的pH与工作前相比将 (填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。A电极附近甲醇发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东广州执信中学高二上期中文化学试卷(解析版) 题型:?????
化学与社会、生活紧密相连。下列说法合理的是( )
A.节日期间,在人群密集处燃放烟花爆竹
B.寻找一种高效催化剂将水直接变成汽油
C.炒菜时油锅中的油不慎着火,迅速盖上锅盖
D.用点燃的火柴在液化气钢瓶口检验是否漏气
查看答案和解析>>
科目:高中化学 来源:2016届浙江临海台州中学高三上学期第三次统练化学试卷(解析版) 题型:选择题
一定条件下合成乙烯: 6H2(g) +2CO2(g)  CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是
CH2=CH2(g) +4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法正确的是

A. 生成乙烯的速率:v(M)一定小于v(N)
B. 化学平衡常数:KN>K M
C. 当温度高于250℃时,升高温度,平衡向逆反应方向移动,从而使催化剂的催化效率降低
D.若投料比n(H2):n(CO2)=3:1,则图中M点时,乙烯的体积分数为7.7%
查看答案和解析>>
科目:高中化学 来源:2016届云南师大附中高考适应性月考(四)理综化学试卷(解析版) 题型:填空题
可逆反应mA(g)+nB(g) pC(g)+ qD(g)△H=a KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。
pC(g)+ qD(g)△H=a KJ/mol,反应时间与C%(产物C的体积分数)函数关系如图13所示。
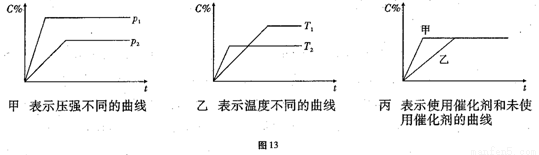
(1)据上述信息试比较下列大小关系:P1_______ P2,T1_______T2,△H_____0,△S_____0(增色填“﹥”“﹤”或“=”),图丙中使用催化剂的是_______反应线。
(2)该反应在_______(填“高温”或“低温”)下能自发进行。
(3)当该反应在两个体积相等的恒容密闭容器中进行反应时,如图:

请分析丙容器和丁容器达到平衡时C%(产物C的体积分数)是否可能相等,_____ (填“能”或“不能”),其原因是_____ _____ _____ 。
(4)假设第(3)问中,图中物质的量不变,在相同温度下达到平衡时丁中A、B的浓度分别是丙中A、B的浓度的ω倍,求m:n的值为 。
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第五次模拟理科综合试卷(解析版) 题型:推断题
位于短周期的四种元素a、b、c、d、e,原子序数依次增大,已知a的单质最轻,d是地壳中含量最多的金属元素,a和d的原子序数之和等于b的原子序数的两倍,e的质子数是c的两倍且同主族。据此回答下列问题
(1)d元素在周期表中的位置 。
(2)有a和b元素组成的四核10电子分子的电子式 。实验室制取该种物质的化学方程式为 。
(3)写出由a和c两种元素形成的18电子的物质的结构式 ,往一定量的氯化亚铁溶液中滴加适量该物质溶液,发生反应的离子方程式为 。
(4)由d和e两种元素组成的化合物投入水中所观察到的现象 ,该过程的化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源:2016届福建省三明市高三上学期第二次月考化学试卷(解析版) 题型:选择题
现有常温下的四种溶液(如下表),下列有关叙述中正确的是
① | ② | ③ | ④ | |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
pH | 11 | 11 | 3 | 3 |
A.V1L④与V2L②溶液混合后,若混合后溶液pH=4,则V1:V2=9:11
B.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
C.分别加水稀释10倍、四种溶液的pH:①>②>③>④
D.将①、④两种溶液等体积混合,所得溶液中:c (NH4+)>c(Cl-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二12月月考化学卷(解析版) 题型:选择题
现有1 L 0.5mol/L的硫酸钠溶液,有关溶液的叙述正确的是
A.取0.5 L溶液,Na+的浓度是0.5 mol/L
B.取0.1 L溶液稀释至l L,SO42-离子浓度是0.05 mol/L
C.溶质的离子总数是6.02×1023个
D.该溶液是把0.5 mol Na2SO4溶于1 L水中配制而成的
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省高一上期中测试化学试卷(解析版) 题型:选择题
在下列变化中,需要加入合适的氧化剂才能实现的是
A.Fe→Fe3+ B.CO2→CO C.Na2O2→O2 D.CuO→Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com