
一定温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) △H>0,下列叙述正确的是( )
Z(g)+W(s) △H>0,下列叙述正确的是( )
A.加入少量的W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的△H增大
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:阅读理解
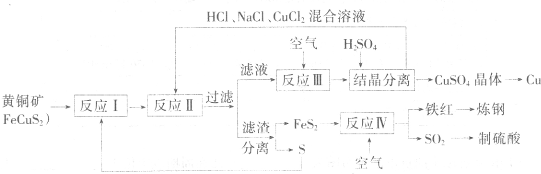
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”.一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:| c(CH3OCH3)?c(CO2) |
| c3(CO)?c3(H2) |
| c(CH3OCH3)?c(CO2) |
| c3(CO)?c3(H2) |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:浙江省海盐元济高级中学2010-2011学年高二3月月考化学试题 题型:022
将1 mol I2(g)和2 mol H2置于2 L密闭容器中,在一定温度下发生反应:
I2(g)+H2(g)![]() 2HI(g);ΔH<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
2HI(g);ΔH<0,并达平衡.HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示:
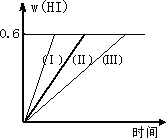
(1)达平衡时,I2(g)的物质的量浓度为________;
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ)所示.则甲条件可能是________,则乙条件可能是________(填入下列条件的序号)
①恒容条件下,升高温度;
②恒容条件下,降低温度;
③恒温条件下,缩小反应容器体积;
④恒温条件下,扩大反应容器体积;
⑤恒温恒容条件下,加入适当催化剂.
(3)若保持温度不变,在另一个相同的2 L密闭容器中加入a mol I2(g)、b mol H2(g)和c mol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.6,则a、b、c的关系是________.
查看答案和解析>>
科目:高中化学 来源:2013-2014学年安徽省安庆市六校高三第三次联考理综化学试卷(解析版) 题型:选择题
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)  4NO2 (g)+ O2(g)? ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
4NO2 (g)+ O2(g)? ΔH > 0;T1温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s | 0 | 500 | 100 0 | 150 0 |
c(N2O5)/ mol·L-1 | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法中不正确的是
A.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则K1<K2
B.500 s内N2O5分解速率为2.96╳10-3mol·L-1·s-1
C.T1温度下的平衡常数为K1=125,平衡时N2O5的转化率为50%
D.达平衡后其他条件不变,将容器的体积压缩到原来的1/2,则c(N2O5)> 5.00 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com