
分析 (1)在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中,根据化合价不交叉的原则,KClO3中+5价的氯元素降为0价,HCl中氯元素升为0价,氯化钾中的氯元素来自盐酸,所以KClO3是氧化剂、部分HCl是还原剂,氧化剂被还原、还原剂被氧化,据此分析解答;
(2)ClO2处理水时,发生反应,NaClO2→ClO2,+3价的氯元素化合价升高到+4价,NaClO2→NaCl,+3价的氯元素的化合价降低到-1价,由得失电子守恒分析;
(3)根据通入足量氯气,当反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2失去的电子数相等,又溶液的体积相同,则浓度之比等于物质的量之比.
解答 解:(1)根据化合价不交叉的原则,在KClO3+6HCl=KCl+3Cl2↑+3H2O的反应中,KClO3中+5价的氯元素降为0价,该氯原子为被还原的氯原子,HCl中氯元素升为0价,该氯原子为被氧化的氯原子,氯化钾中的氯元素来自盐酸,则被氧化发生氧化反应的Cl为5,
所以KClO3是氧化剂、部分HCl是还原剂,氧化剂被还原、还原剂被氧化,被氧化和被还原的元素都是Cl元素,其质量之比等于其物质的量之比=5:1;
反应中转移5mol电子生成3mol氯气,则转移1mol电子时,产生标准状况下的Cl2为0.6mol,其体积为13.44 L;
故答案为:5:1;13.44;
(2)ClO2处理水时,发生反应,NaClO2→ClO2,+3价的氯元素化合价升高到+4价,NaClO2→NaCl,+3价的氯元素的化合价降低到-1价,由得失电子守恒可知,方程式为5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O;生成4molClO2,转移电子4mol,生成0.2mol ClO2转移电子的物质的量为0.2mol;
故答案为:5NaClO2+4HCl=4ClO2↑+5NaCl+2H2O;0.2;
(3)因KI、Na2SO3、FeBr2溶液,分别通入足量氯气均发生氧化还原反应,且反应恰好完全时,三种溶液消耗氯气的物质的量相同,则KI、Na2SO3、FeBr2失去的电子数相等,
设KI、Na2SO3、FeBr2的物质的量分别为x、y、z,由失去的电子数相等可知,
x×(1-0)=y×(6-4)=z×(3-2)+z×2×(1-0),解得x:y:z=6:3:2,
故答案为:6:3:2.
点评 本题考查了氧化还原反应,题目涉及氧化还原反应的计算、方程式的书写等,要求学生具有分析和解决问题的能力,明确元素化合价是解本题关键,题目难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
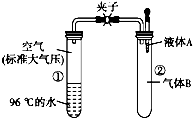 如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②中,一段时间后打开夹子,可发现试管①内的水立刻沸腾 了.(已知,气压减小,水的沸点降低)则液体A和气体B的组合不可能是下列的( )| A. | 氢氧化钠溶液、二氧化碳 | B. | 饱和食盐水、氯化氢 | ||
| C. | 氢氧化钠溶液、一氧化碳 | D. | 石灰水、二氧化硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Na2O2晶体中含有的阴离子数目为2NA | |
| B. | 1 mol Na2O2与足量CO2反应时,转移2NA个电子 | |
| C. | 1 mol•L-1的NaOH溶液中含Na+数目为NA | |
| D. | 1 mol钠与足量氧气反应生成Na2O或Na2O2时,失电子数目均为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸(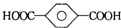 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (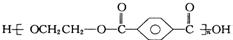 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com