
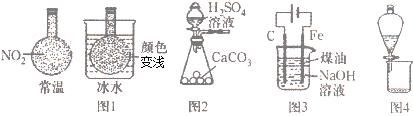
| A、用图1装置说明反应2NO2(g)?N2O4(g)△H<0 |
| B、用图2所示装置可制取大量的CO2气体 |
| C、用图3装置制备Fe(OH)2并能较长时间观察其颜色 |
| D、用图4所示装置可分离溴的四氯化碳溶液和水 |


 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
| A、NaHSO4 MgSO4 Na2CO3 NaOH |
| B、HCl NaOH K2SO4 NaHCO3 |
| C、NaAlO2 KHCO3 NaCl NaHSO4 |
| D、NaOH FeCl3 MgCl2 K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.10mol/L |
| B、0.15 mol/L |
| C、0.20 mol/L |
| D、0.25 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、达到化学平衡时,5v正(O2)=4v逆(NO) |
| B、达到化学平衡时,3v正(NO)=2v正(H2O) |
| C、当NH3、O2、NO和H2O的浓度相等时,反应一定达到平衡状态 |
| D、达到化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、W-、X3+及Y2-均能破坏水的电离平衡 |
| B、最外层电子数:W>X>Y>Z |
| C、离子半径:W>X>Y>Z |
| D、单质沸点:W>Y>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
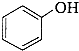
 )是一种重要的有机化工原料.
)是一种重要的有机化工原料.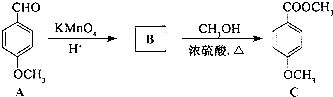
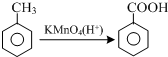 .
.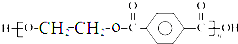 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①⑦ | B、②⑦ | C、③④ | D、④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
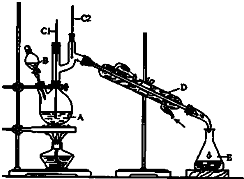 正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.
正丁醛是一种化工原料.某实验小组利用如图装置合成正丁醛.| Na2Cr2O7 |
| H2SO4△ |
| 沸点/.c | 密度/(g?cm-3) | 水中溶解性 | |
| 正丁醇 | 111.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com