
分析 X、Y、Z、D、G五种元素分属三个短周期,且原子序数依次增大,X、Z同主族,可形成离子化合物ZX,ZX焰色反应为黄色,可推知X为H,Z为Na;根据Y、D同主族,可形成DY2、DY3两种分子,可推知D为S,Y为O,则G只能是Cl.
解答 解:X、Y、Z、D、G五种元素分属三个短周期,且原子序数依次增大,X、Z同主族,可形成离子化合物ZX,ZX焰色反应为黄色,可推知X为H,Z为Na;根据Y、D同主族,可形成DY2、DY3两种分子,可推知D为S,Y为O,则G只能是Cl.
(1)D为S元素,在元素周期表中的位置为:第三周期ⅥA族,同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>S>O,故答案为:第三周期ⅥA族;Na>S>O;
(2)上述元素的最高价氧化物对应的水化物中酸性最强的是HClO4,上述元素中S元素非金属性最弱,非金属气态氢化物中还原性最强的是:H2S,故答案为:HClO4;H2S;
(3)由O、Cl两元素形成的可作饮用水消毒剂的化合物的是:ClO2,故答案为:ClO2.
点评 本题考查结构性质位置关系应用,比较基础,注意对元素周期律的理解与应用,有利于基础知识的巩固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
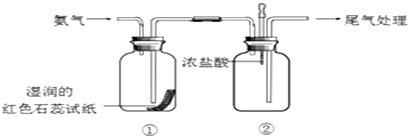
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开启啤酒瓶后,瓶中立刻泛起大量泡沫 | |
| B. | 硫酸工业中,将黄铁矿粉碎后加入沸腾炉中 | |
| C. | 500℃左右比在室温时更有利于提高合成氨的转化率 | |
| D. | 对2HI?H2+I2平衡体系增加压强使颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨气通入醋酸中:CH3COOH+NH3═CH3COO-+NH4+ | |
| B. | 向碳酸氢镁溶液中加过量石灰水:Mg2++2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+MgCO3↓ | |
| C. | 澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O | |
| D. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOC-COOH | D. | CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤炭经过干馏,石油经分馏、裂化、裂解化工处理,可获得清洁能源和重要的化工原料 | |
| B. | 比能量低而笨重的铅蓄电池使用时电压不稳定,所以有被其他新型电池取代的趋势 | |
| C. | 玛瑙饰品的主要成分与建筑材料砂子相同 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料单晶硅也可以制备电脑芯片 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
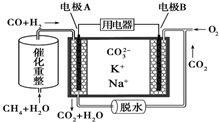
| A. | 放电时负极有CO2生成 | |
| B. | 正极反应为O2+2CO2+4e-═2CO32- | |
| C. | 反应CH4+H2O$→_{△}^{催化剂}$3H2+CO,每消耗1molCH4转移6mol 电子 | |
| D. | 该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
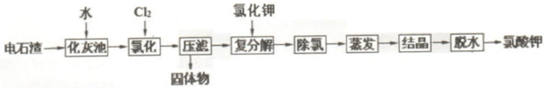
| 温度/ | 0 | 10 | 20 | 30 | 40 |
| S(CaCl2)/g | 59.5 | 64.7 | 74.5 | 100 | 128 |
| S[Ca(ClO3)2]/g | 209 | ||||
| S(KClO3)/g | 3.3 | 5.2 | 7.3 | 10.2 | 13.9 |
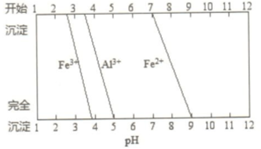
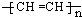 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 体系有自发地向混乱度增加(即熵增)的方向转变的倾向,这是自然界的普遍规律 | |
| B. | 判断过程的自发性能确定过程能否发生和过程发生的速率 | |
| C. | 其它条件相同时,增大反应物浓度能使分子获得能量,活化分子百分数提高,反应速率增大 | |
| D. | 催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com