
| A. | 原子序数是24 | |
| B. | 最高价氧化物是SeO3,是酸性氧化物 | |
| C. | 原子半径比钙小 | |
| D. | 气态氢化物化学式是H2Se,稳定性比HCl差 |
分析 硒元素与氧元素同主族,与Ca元素同周期,则Se在元素周期表中的第四周期第ⅥA族,利用同主族元素的性质变化规律来解答.
解答 解:A.硒元素与氧元素同主族,与钾元素同周期,Se在元素周期表中的第四周期第ⅥA族,原子序数为34,故A错误;
B.第ⅥA族元素的最高价为+6价,则最高价氧化物的化学式为SeO3,与同主族的S的化合物性质相似,属于酸性氧化物,故B正确;
C.同周期从左到右原子半径逐渐减小,则原子半径比钙小,故C正确;
D.非金属性越强,则气态氢化物越稳定,已知非金属性:Cl>S>Se,则氢化物的稳定性:HCl>H2Se,故D正确;
故选A.
点评 本题考查元素周期表和元素周期律,明确Se元素在周期表中的位置及元素周期律是解答本题的关键,难度不大.


科目:高中化学 来源: 题型:解答题
 在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.
在一定温度下,体积为2L的密闭容器中,NO2和N2O4之间发生反应:2NO2(g)(红棕色)═N2O4(g) (无色),如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验结论 |
(1)A的质谱图如下: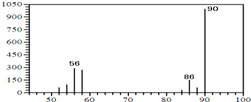 | (1)证明A的相对分子质量为90. |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)证明A的分子式为: C3H6O3. |
| (3)另取两份9.0g A分置于不同的试管中.往其中一份A中加入足量的NaHCO3粉末充分反应,生成2.24 L CO2(标准状况). 往另一份A中加入足量金属钠充分反应,生成2.24 L H2(标准状况). | (3)证明A的分子中含有羧基和羟基官能团. |
(4)A的核磁共振氢谱如图: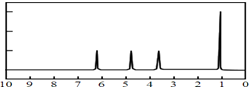 | (4)A的结构简式为: . . |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
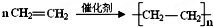 .
.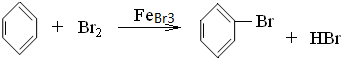 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体扩散速率与扩散面积成正比 | |
| B. | 气体扩散速率与气体溶解度和分子量成正比 | |
| C. | 气体扩散速率与分压差成正比 | |
| D. | 气体扩散速率与温度成正比 | |
| E. | 气体扩散速率与扩散距离成反比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com