
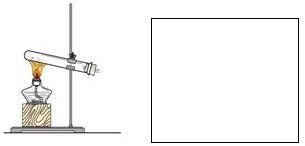
写出实验室制氨气的化学方程式:_____________________________________________。
在下图方框内画出氨气的收集装置(夹持装置可略去)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| ||


| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
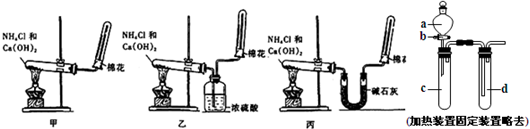
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
(15分)
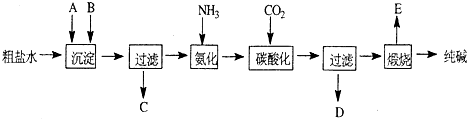
工业生产纯碱的工艺流程示意图如下:
完成下列填空:
(1)沉淀剂A来源于石灰窑厂,写出A、B的化学式。
A B
(2)实验室提纯粗盐的实验操作依次为:取样、 、沉淀、 、 。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象 。碳酸化时没有析出碳酸钠晶体,其原因是 。
(4)碳酸化后过滤,滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法: 。
(5)向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 (填a、b、c字母) 。这样做使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 的循环,这就是有名的侯氏制碱法。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省晋中市高三第二次模拟考试(理综)化学部分 题型:填空题
(15分)
工业生产纯碱的工艺流程示意图如下:

完成下列填空:
(1)沉淀剂A来源于石灰窑厂,写出A、B的化学式。
A B
(2)实验室提纯粗盐的实验操作依次为:取样、 、沉淀、 、 。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象 。碳酸化时没有析出碳酸钠晶体,其原因是 。
(4)碳酸化后过滤,滤液D最主要的成分是 (填写化学式),检验这一成分的阴离子的具体方法: 。
(5)向滤液D中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 (填a、b、c字母) 。这样做使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 的循环,这就是有名的侯氏制碱法。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:
(注明你的表达式中所用的有关符号的含义)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com