
分析 (1)①Ca2++CO32-═CaCO3↓可表示可溶性钙盐与可溶性碳酸盐反应生成碳酸钙和可溶性盐的反应;
②Cu2++Fe═Cu+Fe2+可表示Fe与可溶性铜盐的反应;
(2)碳酸钠与盐酸反应生成气体,与氯化钡反应生成白色沉淀,而石灰水均不能.
解答 解:(1)①Ca2++CO32-═CaCO3↓可表示可溶性钙盐与可溶性碳酸盐反应生成碳酸钙和可溶性盐的反应,如CaCl2+Na2CO3═CaCO3↓+2NaCl,
故答案为:CaCl2+Na2CO3═CaCO3↓+2NaCl;
②Cu2++Fe═Cu+Fe2+可表示Fe与可溶性铜盐的反应,如Fe+CuCl2═Cu+FeCl2,故答案为:Fe+CuCl2═Cu+FeCl2;
(2)碳酸钠与盐酸反应生成气体,与氯化钡反应生成白色沉淀,而石灰水均不能,现象不同可鉴别,而二者均不与NaCl反应,即鉴别试剂可为AC,故答案为:AC.
点评 本题考查离子反应方程式的意义及物质鉴别,为高频考点,把握离子反应的意义可表示一类或一个反应及物质性质差异为解答的关键,侧重分析与应用能力的考查,注意(1)中答案不唯一,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
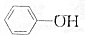 ,③
,③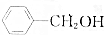 ,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )
,④CH3COOH,⑤CH3COOCH3,⑥CH2=CH-CH2OH.根据官能团的不同可分为( )| A. | 3类 | B. | 4类 | C. | 5类 | D. | 6类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H1<△H2 | |
| B. | 生成物总能量均高于反应物总能量 | |
| C. | 生成1molHCl气体时放出|△H1|热量 | |
| D. | 1molHBr(g)具有的能量小于1molHBr(l)具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2的摩尔质量与NA个Cl2分子的质量在数值上相同 | |
| B. | 活泼金属从盐酸中置换出1mol H2,转移电子数为NA | |
| C. | 500mL 0.5mol•L-1Al2(SO4)3溶液中,含Al3+数目为0.5NA | |
| D. | 常温常压下,0.5 NA个一氧化碳分子所占体积是11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的硫酸溶液中c(H+):c(SO42-)等于2:1,稀释10000倍后二者的比值几乎不变 | |
| B. | 由水电离的c(H+)=10-12mol/L的溶液中K+、Ba2+、Cl-、Br-、HCO3-一定能大量共存 | |
| C. | 1.0×10-3mol/L盐酸溶液的pH=3,则1.0×10-8mol/L盐酸溶液的pH=8 | |
| D. | 某温度下水的离子积为1.0×10-12,等体积的pH=1的H2SO4溶液与pH=11的NaOH溶液混合后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素A、B组成的化合物常温下一定呈气态 | |
| B. | 元素C、D、E的最高价氧化物对应的水化物两两之间能发生反应 | |
| C. | 工业上常用电解C、D的盐溶液来制备C、D元素的单质 | |
| D. | 化合物AE与CE有相同类型的化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com