
 东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是
东晋葛洪《肘后备急方》一书中记载:“青蒿一握,以水二升渍,绞取汁,尽服之”. 屠呦呦团队在世界率先确定了青蒿素结构式如图所示.下列说法错误的是| A. | 青蒿素的分子式为C15H22O5 | |
| B. | 青蒿乃中药,宜采取水煎煮熬汁的方法服用 | |
| C. | 青蒿素难溶于水,提取的方法是用有机溶剂萃取 | |
| D. | 青蒿素分子中有2种非极性键和3种极性键 |
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
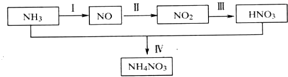
科目:高中化学 来源: 题型:解答题
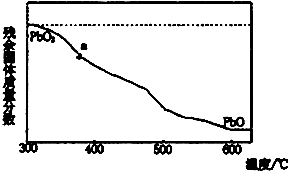 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 溶液 | 粒子浓度关系 |
| A | CH3COOK溶液中加入少量NaNO3固体后 | c(K+)+c(H+)=c(CH3COO-)+c(OH-) |
| B | 新制氯水 | c(Cl-)>c(H+)>c(OH-)>c(ClO-) |
| C | NH4HSO4溶液 | c(H+)=c(NH4+)+c(NH3•H2O)+c(OH-) |
| D | 0.1mol•L-1,pH为4的NaHB溶液 | c(HB-)>c(H2B)>c(B2-) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

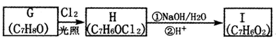
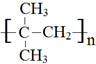 .
.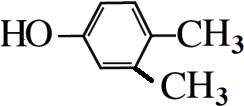 .
.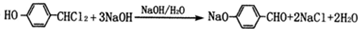 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
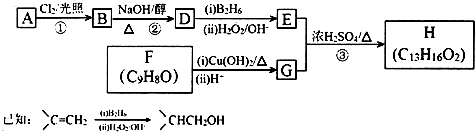

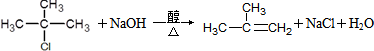 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石 | B. | 石墨 | C. | 铜 | D. | 铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
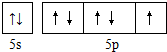 .
.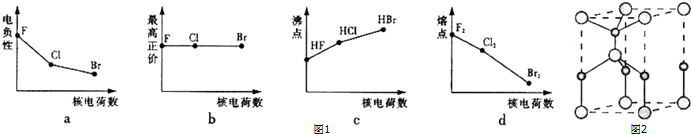
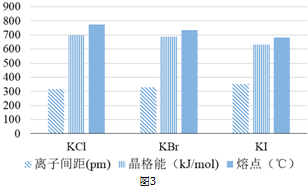
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )
甲、乙、丙、丁、戊五种物质中,甲、乙、丙均含有相同的某种元素,丁是一种常见气体单质,它们之间具有如图所示转化关系.下列有关物质的推断不正确的是( )| A. | 若甲为Na,则戊可能是H2O | B. | 若甲为C2H4,则戊可能是O2 | ||
| C. | 若甲为NO,则戊可能是H2O | D. | 若甲为Cl2,则戊可能是NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com