
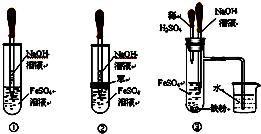
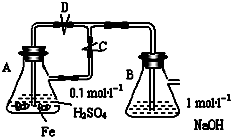
分析 (1)氢氧化亚铁能够与空气中氧气发生反应4Fe(OH)2+O2+2H2O=4Fe(OH)3,要较长时间保存Fe(OH)2沉淀,只要满足在制取过程中尽可能减少和空气接触即可,据此对各选项进行判断;
(2)①打开C后铁与硫酸反应生成氢气,关闭C后A中压强增大,硫酸亚铁溶液进入B,反应生成氢氧化亚铁白色沉淀;
②若弹簧夹C关闭一会儿,容器A中的反应还在进行时,B容器中仍有氧气,利用A产生的氢气产生的压强将硫酸亚铁压入锥形瓶B中,在锥形瓶B中生成氢氧化亚铁,则B中应该盛放氢氧化钠溶液,生成的氢氧化亚铁,B容器中仍有氧气,生成的氢氧化亚铁被空气氧化生成氢氧化铁.
解答 解:(1)根据题中信息可知要较长时间保存Fe(OH)2沉淀,必须在制取过程中尽可能减少和空气接触,②中盛有氢氧化钠溶液的滴管伸入放有还原性铁粉的硫酸亚铁溶液中,可以避免试管中部分氧气对氢氧化亚铁的氧化,则能减少与氧气接触;③Fe和稀硫酸生成氢气能排出装置中的氧气,所以也能减少与氧气接触,只有①生成的氢氧化亚铁能够与空气中氧气发生反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3,导致不能长时间观察到氢氧化亚铁,
故答案为:②③;
(2)①若先打开C,H2进入B,驱出B中O2,再关闭C,A中Fe2+进入B,只能生成Fe(OH)2,故答案为:开始时容器B中的导管口有气泡冒出,弹簧夹关闭后容器A中溶液进入容器B,有白色沉淀生成;
②若开始关闭C,A中反应生成H2,压强增大,A中溶液由导管进入B,B中Fe2+与OH-反应生成Fe(OH)2白色沉淀,Fe(OH)2与B中O2反应生成红褐色沉淀Fe(OH)3,反应的化学方程式为:2NaOH+FeSO4═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3,
故答案为:有白色沉淀生成,沉淀迅速变为灰绿色,最后变成红褐色;2NaOH+FeSO4═Fe(OH)2↓+Na2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3.
点评 本题考查铁的相关知识和铁的化合物之间的转化,除杂、检验等内容,注意方程式的书写,难度不大.


 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:选择题
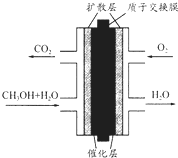 直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )| A. | 通入O2的电极反应式为:O2+4e-+2H2O═4OH- | |
| B. | 电池内部H+由正极渗过交换膜向负极移动 | |
| C. | 甲醇在正极发生反应,电流经过外电路流向负极 | |
| D. | 注入CH3OH的电极反应式为:CH3OH+H2O-6e-═CO2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Al2O3、SiCl4均为共价化合物 | |
| B. | 生产过程中均涉及氧化还原反应 | |
| C. | 石英可用于制光导纤维,晶体Si常用做半导体材料 | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用于冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na202与足量H20反应生成标况下11.2L 02.转移电子的数目为2NA | |
| B. | 标准状况下,2.24L S03中所含电子数为4NA | |
| C. | 用惰性电极电解CuS04溶液后,如果加入0.1mol Cu(0H)2能使溶液复原,则电路中转移电子的数目为0.2NA | |
| D. | 0℃和101kp的条件下,1.12L甲烷完全燃烧生成的水分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
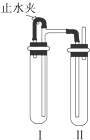 用下面两种方法均可制得Fe(OH)2白色沉淀.
用下面两种方法均可制得Fe(OH)2白色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
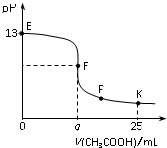 25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )| A. | a=12.5,且混合溶液pH=7 | |
| B. | 对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | |
| D. | K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
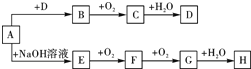 A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:
A~H等8种物质存在如下转化关系(反应条件,部分产物未标出).已知:A是正盐,B是能使品红溶液褪色的气体,G是红棕色气体.按要求回答问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com