
����Ŀ���״�����Ҫ�Ļ���ԭ�ϣ�Ҳ��һ�����ʵ�ȼ�ϡ�
��.�״�������ȡ��ȩ��ԭ��ΪCH3OH(g)![]() HCHO(g) +H2(g)��ij����С����2 L�ܱ������г���1 mol CH3OH���Ը÷�Ӧ������һϵ�е��о����õ��״���ƽ��ת�������¶ȵı仯������ͼ��ʾ��
HCHO(g) +H2(g)��ij����С����2 L�ܱ������г���1 mol CH3OH���Ը÷�Ӧ������һϵ�е��о����õ��״���ƽ��ת�������¶ȵı仯������ͼ��ʾ��
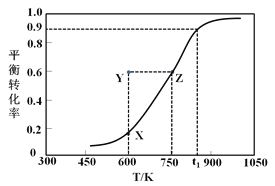
��1������ѡ���У���˵���÷�Ӧ�ﵽƽ��״̬����__________��
a��v(CH3OH) =v(HCHO) b��H2������������ٱ仯
c����ȩ�������������ٸı� d����������ܶȲ���
��2����t1ʱ���÷�Ӧ��ƽ�ⳣ��ΪK=________________�����¶��£��ӷ�Ӧ��ʼ��ƽ����������ʱ��Ϊ5 s����v(HCHO)Ϊ_______mol/(L��min)�������������ͨ��1.1 mol CH3OH��1.1 mol H2����ƽ����_________�������Ӧ�����淴Ӧ���������ƶ���
��3��600 Kʱ��Y��״���v(��)_______v(��) (�>������<����=��)��������_____________________��
��.��֪��CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ��H1=��a kJ/mol��
2Cu(s)+O2(g)=2CuO(s) ��H2=��b kJ/mol��
��4������ͭ������ʱ��2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g) ��H3=______kJ/mol���ú�a��b�Ĵ���ʽ��ʾ����
��.��ͼ��ʾ����NaOH��ҺΪ�������Һ�ļ״�ȼ�ϵ�أ�

��5��a���缫��ӦʽΪ__________________________������ĤΪ�����ӽ���Ĥ�����ع���һ�κ�ظ�������Һ��n(OH��)_____�����������С�����䡱����
���𰸡� bc 4.05mol/L 5.4 ����Ӧ < Y��״���ת���ʴ���X�㣬��Ӧ���淴Ӧ������� ��(2a+b) CH3OH+8OH����6e��=CO32��+6H2O ��С
����������.��1��a��û��ָ�����������ʣ�����Ϊ����Ӧ��Ӧ���ʣ����߷�Ӧ����ʼ����ȣ���a����b���淴Ӧ����������Ũ������H2��Ũ�Ȳ��ٱ仯ʱ��˵������ƽ�⣬��b��ȷ��c����ȩ�������������ٸı䣬˵������ƽ�⣬��c��ȷ��d������������������䣬����������䣬���������ܶ�ʼ�ղ��䣬����˵������ƽ�⣬��d���ʴ�Ϊbc��
��2����ͼ��֪��t1Kʱ�״���ת����Ϊ0.9����μӷ�Ӧ�״������ʵ���Ϊ0.9mol���������Ϊ1L����״�����ʼŨ��Ϊ1mol/L��Ũ�ȱ仯��Ϊ0.9mol/L����
CH3OH��g��![]() HCHO��g��+H2��g��
HCHO��g��+H2��g��
��ʼ��mol����1 00
ת����mol����0.9 0.9 0.9
ƽ�⣨mol����0.1 0.9 0.9
��T1Kʱ��ƽ�ⳣ��K=![]() =
=![]() =4.05�����¶��£��ӷ�Ӧ��ʼ��ƽ����������ʱ��Ϊ5s����v��HCHO��=
=4.05�����¶��£��ӷ�Ӧ��ʼ��ƽ����������ʱ��Ϊ5s����v��HCHO��=![]() =5.4mol/(L��min)���ﵽƽ������������������ͨ��1.1molCH3OH��1.1molH2����ʱ��Ũ����Qc=
=5.4mol/(L��min)���ﵽƽ������������������ͨ��1.1molCH3OH��1.1molH2����ʱ��Ũ����Qc=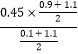 =0.083��K=4.05��ƽ��������Ӧ������У�
=0.083��K=4.05��ƽ��������Ӧ������У�
��3����ͼ��֪��Y���ת���ʸ�����ͬ�¶���ƽ���X��ת���ʣ���Y�㷴Ӧ���淴Ӧ�����ƶ�����v��������v���棩��
��.��4����֪����CH3OH(g) +CuO(s)=HCHO(g) +Cu(s)+H2O(g) ��H1=��a kJ/mol����2Cu(s)+O2(g)=2CuO(s) ��H2=��b kJ/mol�����ݸ�˹����������2+���ɵ�2CH3OH(g)+O2(g)=2HCHO(g)+2H2O(g)����H3=��H1��2+��H2=��(2a+b)kJ/mol��
��.��5��ȼ�ϵ��ͨ�����ļ�Ϊ��������bΪ������aΪ�����������ϼ״�ʧ���ӷ���������Ӧ����NaOHΪ�������Һʱ����ΪCO32-����a���缫��ӦʽΪCH3OH+8OH����6e��=CO32��+6H2O������ĤΪ�����ӽ���Ĥ��b����OH-�������ӽ���Ĥ����a���ң���ÿת��6mol���ӣ�ֻ��ת��6molOH-����a����Ҫ����8molOH-���ʵ�ع���һ�κ�ظ�������Һ��n(OH��)��С��


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����t��Cʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ��ʾ����֪t��CʱAgCl��Ksp=4��10-10������˵������ȷ����( )
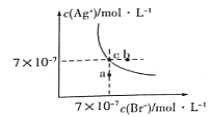
A��ͼ��a���Ӧ����AgBr�IJ�������Һ
B����t ��Cʱ��AgBr��KspΪ 4.9��10-13
C����AgBr������Һ�м���NaBr���壬��ʹ��Һ��c�㵽b��
D����t ��Cʱ��AgCl(s)+Br-(aq)![]() AgBr(s)+C1- (aq)��ƽ�ⳣ��K��816
AgBr(s)+C1- (aq)��ƽ�ⳣ��K��816
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ����������Ħ��������44g B. SO42-��Ħ��������96g/mol
C. 1molO2��������32g/mol D. ����Ħ�����������������ԭ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ�����б�����ȷ���ǣ� ��
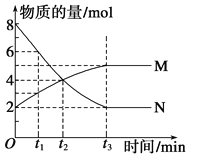
A. ��Ӧ�Ļ�ѧ����ʽ��2M![]() N
N
B. t2ʱ�������淴Ӧ������ȣ��ﵽƽ��
C. t3ʱ������Ӧ���ʴ����淴Ӧ����
D. t1ʱN��Ũ����MŨ�ȵ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������A������2 mol����0.5 L�����м��ȣ������ֽⷴӦ2A(g) ![]() B(g)��nC(g)����Ӧ��3 minʱ��������A��Ũ��Ϊ1.6 mol��L��1��������ʱ���ڣ���C��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(C)��1.2 mol��L��1��min��1��
B(g)��nC(g)����Ӧ��3 minʱ��������A��Ũ��Ϊ1.6 mol��L��1��������ʱ���ڣ���C��Ũ�ȱ仯��ʾ��ƽ����Ӧ����v(C)��1.2 mol��L��1��min��1��
(1)��ѧ����ʽ�еĻ�ѧ������n��ֵ��__________��
(2)��B��Ũ�ȱ仯��ʾ�ĸ÷�Ӧ��ƽ������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.CS2�Ǽ��Լ����ɵļ��Է���
B.SO2��CO2Ϊ�ȵ�����
C.������������������ѻ����������������ѻ�����ʽ�ռ����������
D.1molNaHSO4����̬ʱ��3mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���1L�����ܱ������м���lmol��N2(g)��3molH2(g)������Ӧ��N2(g)+3H2(g) ![]() 2NH3(g) ��H<0�� NH3�����ʵ�����ʱ��Ĺ�ϵ���±���ʾ������˵���������
2NH3(g) ��H<0�� NH3�����ʵ�����ʱ��Ĺ�ϵ���±���ʾ������˵���������
ʱ��(min) | 0 | t1 | t2 | t3 |
NH3���ʵ���(mol) | 0 | 0.2 | 0.3 | 0.3 |
A. 0t1min��v(NH3)=![]() mol��L-1��min-1
mol��L-1��min-1
B. �����¶ȣ���ʹ����Ӧ���ʼ�С���淴Ӧ��������ƽ������
C. N2(g)+3H2(g) ![]() 2NH3(g)�Ļ��С��2NH3(g)
2NH3(g)�Ļ��С��2NH3(g) ![]() N2(g)+3H2(g)�Ļ��
N2(g)+3H2(g)�Ļ��
D. t3ʱ�ټ���1mol��N2(g)��3molH2(g)����Ӧ����ƽ��ʱ��c(N2)>0.85mol��L-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪3.6 g̼�� 6.4 g������ȼ�գ�����Ӧ��ľ������ų�X kJ��������֪����̼��ȼ����ΪY kJ/mol����1 mol C��O2��Ӧ����CO�ķ�Ӧ�Ȧ�HΪ
A����Y kJ/mol B������5X��0.5Y�� kJ/mol
C������10X��Y�� kJ/mol D������10X��Y��kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com