
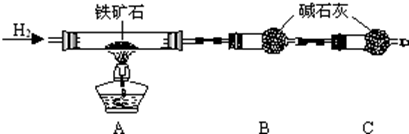
分析 Ⅰ.(1)组装仪器完毕,需要检验装置的气密性;
(2)B中的碱石灰是吸收置换反应生成的水的,为了防止空气成分对实验的影响,要加一个装置吸收空气中的水以及二氧化碳;
(3)反应后装置B增重1.35g,即氢气和氧化铁反应后固体质量的增加值,可以根据差量法来计算;
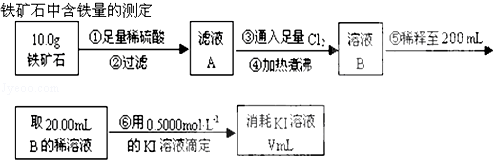
Ⅱ.(1)煮沸可以将水中的气体赶走;
(2)根据滴定试验以及滴定过程中的实验误差分析知识来回答判断;
(3)根据元素守恒和化学反应方程式进行计算.
解答 解:Ⅰ.(1)组装仪器完毕,需要检验装置的气密性,
故答案为:检验装置的气密性;
(2)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,所以C装置要防止防止空气中的水蒸气和CO2进入B中,影响测定结果,
故答案为:防止空气中的水蒸气和CO2进入B中,影响测定结果;
(3)测的反应后装置B增重1.35g,根据反应的实质,增加的是水的质量,根据质量守恒定律,所以铁矿石中氧的百分含量是:$\frac{\frac{2.7}{18}×16}{10.0}$×100%=24%,
故答案为:24%;
Ⅱ.(1)向铁矿石中加入硫酸,化反应生成硫酸的铁盐溶液,还存在过量的硫酸溶液,加入过量的氯气,煮沸后可以降低氯气的溶解度,赶走溶液中溶解的过量的Cl2,
故答案为:赶走溶液中溶解的过量的Cl2;
(2)a.滴定管用蒸馏水洗涤后必须用标准液润洗,故a错误;
b.锥形瓶不需要用待测液润洗,故b正确;
c.滴定过程中,眼睛注视锥形瓶中颜色的变化,故c错误;
d.滴定结束后,30s内溶液不恢复原来的颜色再读数,故d正确.
故答案为:bd;
(3)根据反应的方程式为2Fe3++2I-=2Fe2++I2可知,消耗的碘离子与铁离子物质的量相等,n(Fe3+)=n(KI),即:0.4000mol•L-1×0.025L=c(Fe3+)×0.02L,解得c(Fe3+)=0.5mol•L-1,所以铁元素的百分含量为:$\frac{0.5mol/L×0.25L×56g/mol}{10g}$×100%=70%,
故答案为:70%.
点评 本题考查了探究铁矿石中氧元素和铁元素的含量的方法,该题是高考中的常见题型,属于中等难度的试题,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力;该类试题综合性强,理论和实践的联系紧密,要求学生必须认真、细致的审题,联系所学过的知识和技能,全面细致的思考才能得出正确的结论,难度中等.


科目:高中化学 来源: 题型:选择题
 2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:
2015年10月26日,连接上海与杭州的沪杭城际高铁正式开通运营,从上海到杭州只需要45分钟.工业上利用铝热反应焊接钢轨间的缝隙,反应方程式如下:| A. | 氧化剂 | B. | 既是氧化剂又是还原剂 | ||
| C. | 还原剂 | D. | 既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4→HCl→NaOH→CO2 | B. | Na2SO4→NaCl→NH3•H2O | ||
| C. | NaCl→Na2SO4→NaOH | D. | Na2SO4→NaCl→NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
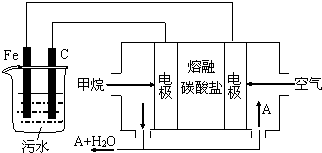
| A. | 该燃料电池是以熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,则负极的电极反应是CH4+4CO32--8e-═5CO2+2H2O | |
| B. | 实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣,此时,可以向污水中加入适量的稀H2SO4 | |
| C. | 实验过程中,若阴极产生2mol气体,则燃料电池消耗11.2L CH4 | |
| D. | 为了使该电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时必须有部分A参加循环,则A物质是CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCO3-+H2O?H3O++CO32- | B. | NH4++H2O?NH3•H2O+OH- | ||
| C. | PO43-+H2O?HPO42-+OH- | D. | H2O+H2O?H3O++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定是单质 | B. | 一定是混合物 | ||
| C. | 可能是单质也可能是化合物 | D. | 可能单质是也可能是混合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com