
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍; W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是:
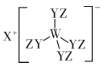
A.原子半径:W<X<Y<Z
B.简单离子的氧化性:W> X
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
【答案】A
【解析】
首先发现X是+1价的,则X为氢、锂或钠,但是W、X、Y三种简单离子的核外电子排布要相同,则X只能是钠,才能满足题意;W、Y、Z三者分别位于三个不同的周期,则必有一种为氢,根据题目给出的结构式,氢只能形成1个键,则Z是氢;结合Y的最外层电子数是W的最外层电子数的二倍,且二者简单离子的核外电子排布相同,则只能是氧和铝,根据结构不难发现W是铝,Y是氧,据此来解题即可。
A.根据分析,四种元素的半径大小为氢<氧<铝<钠,即Z<Y<W<X,A项错误;
B.钠单质的还原性强于铝,而![]() 的氧化性弱于
的氧化性弱于![]() ,B项正确;
,B项正确;
C.过氧化钠和过氧化氢均具有漂白性,C项正确;
D.W与X的最高价氧化物的水化物分别为![]() 和
和![]() ,二者可以相互反应,D项正确;
,二者可以相互反应,D项正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.按系统命名法,CH3CH(C2H5)CH2CH(CH3)2的命名为: 2-甲基-4-乙基戊烷
B.若两种二肽互为同分异构体,则二者的水解产物一定不相同
C.![]() 的单体是CH3-C≡C-CH3和CH2=CH-CN
的单体是CH3-C≡C-CH3和CH2=CH-CN
D.已知![]() 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两种有机物A![]() 与B(
与B(![]() ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )
A.一定条件下,二者在NaOH溶液中均可发生取代反应
B.二者在NaOH醇溶液中均可发生消去反应
C.二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶2
D.A的一氯代物只有1种、B的一溴代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)相同条件下,0.1 mol·L-1NH4Al(SO4)2溶液中c((NH4+)_________(填“等于”、“大于”或“小于”) 0.1 mol·L-1NH4HSO4溶液中c(NH4+)
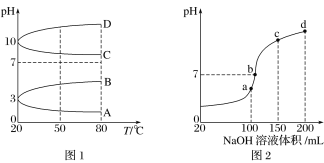
(2)如图1是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2溶液的pH随温度变化的曲线是______(填字母)。
②室温时,0.1 mol·L-1NH4Al(SO4)2溶液中2c(SO42-)- c(NH4+)-3c(Al3+)=________ mol·L-1
(3)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图2所示。 试分析图中a、b、c、d四个点,水的电离程度最大的是____________; 在b点,溶液中各离子浓度由大到小的排列顺序是___________________。
(4)用0.1mol/LNaOH溶液滴定盐酸溶液,下列操作中使结果偏高的是___________________
A.盛标准溶液的滴定管用蒸馏水洗涤后未用标准液润洗就装液滴定
B.锥形瓶用蒸馏水洗涤后未用待测液润洗
C.读取标准液读数时,滴定前平视,滴定到终点后俯视
D.滴定前盛标准液的滴定管尖嘴处有气泡未排除,滴定后气泡消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是高效的抗疟疾药,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差。已知:乙醚沸点35℃,提取青蒿素的主要工艺为:
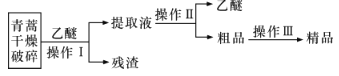
下列有关此工艺操作的说法不正确的是
A.破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素浸取率
B.操作I需要用到的玻璃仪器有漏斗、玻璃棒、烧杯
C.操作II是蒸馏,利用了乙醚与青蒿素的沸点相差较大
D.操作II的主要过程为加水溶解,蒸发浓缩、冷却结晶、过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为确定一种从煤中提取的液态烃X的结构,对其进行探究。
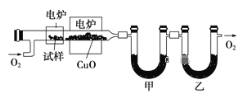
步骤一:这种碳氢化合物蒸气通过热的氧化铜(催化剂),氧化成二氧化碳和水,再用装有无水氯化钙和固体氢氧化钠的吸收管完全吸收.2.12g有机物X的蒸气氧化产生7.04g二氧化碳和1.80g水;
步骤二:通过仪器分析得知X的相对分子质量为106;
步骤三:用核磁共振仪测出X的1H核磁共振谱有2个峰,其面积之比为2∶3 (如图Ⅰ)

步骤四:利用红外光谱仪测得X分子的红外光谱如图Ⅱ,试回答:
(1)步骤二中的仪器分析方法称为___________。
(2)X的分子式为___________;(写出计算过程)X的结构简式为___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化碱法是工业上制备Na2S2O3的方法之一,反应原理:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2(该反应ΔH>0),某研究小组在实验室用硫化碱法制备Na2S2O3·5H2O流程如下:
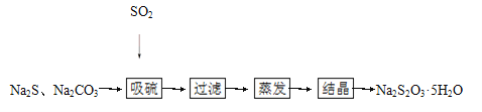
(1)吸硫装置如图所示:
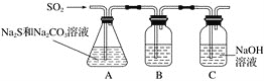
①装置B的作用是检验装置A中SO2的吸收效率,B中试剂是____________,表明SO2吸收效率低的实验现象是B中_________。
②为了使SO2尽可能吸收完全,在不改变A中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是________、________。(写出两条)
(2)Na2S2O3溶液是定量实验中的常用试剂,测定其浓度的过程如下:准确称取ag KIO3(化学式量:214)固体配成溶液,加入过量KI固体和H2SO4溶液,滴加指示剂,用Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液的体积为VmL。则c(Na2S2O3)=_________ mol·L-1。(只列出算式,不作运算)已知:![]() +I2=
+I2=![]() +2I-
+2I-
(3)某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的Na2S2O3浓度可能 ____(填“无影响”、“偏低”或“偏高”),原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温下气体反应达到化学平衡,平衡常数K=c(A)·c2(B)/[c2(E)·c(F)],恒容时,若温度适当降低,F的浓度增加,下列说法正确的是( )
A. 增大c(A)、c(B),K增大
B. 降低温度,正反应速率增大
C. 该反应的焓变为负值
D. 该反应的化学方程式为2E(g)+F(g)![]() A(g)+2B(g)
A(g)+2B(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能表示H2(g)+ I2(g)![]() 2HI(g)已经达到平衡状态的标志是( )
2HI(g)已经达到平衡状态的标志是( )
①c(H2)=c(I2)=c(HI)时
②c(H2):c(I2):c(HI)=1:1:2时
③c(H2)、c(I2)、c(HI)不再随时间而改变
④单位时间内生成nmolH2的同时生成2nmolHI
⑤单位时间内生成nmolH2的同时生成nmolI2
⑥反应速v(H2)=v(I2)=1/2v(HI)
⑦一个H-H键断裂的同时有两个H-I键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
条件一定,混合气体的平均相对分子质量不再变化
A.③④⑦⑨⑩B.③④⑦⑨C.②③④⑦⑨D.②③④⑥⑦⑨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com