
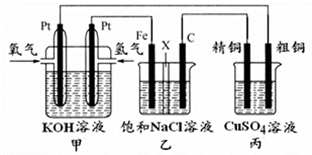
 某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
某同学设计一个燃料电池(如图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.分析 (1)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,负极上失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(2)电解饱和氯化钠溶液时,连接原电池负极的电极是阴极,连接原电池正极的电极是阳极,阳极上氯离子放电,阴极上氢离子放电,导致氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
(3)粗铜精炼时,粗铜作阳极,阳极上金属失电子,阴极上铜离子得电子,根据阴阳极上金属的变化确定溶液中铜离子是否变化;
(4)串联电池中转移电子数相等,根据转移电子数相等计算乙装置中阳离子交换膜左侧溶液质量变化.
解答 解:(1)燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,负极上失电子发生氧化反应,电极反应为H2-2e-+2OH-═2H2O,
故答案为:负;H2-2e-+2OH-═2H2O;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度大于氢离子浓度溶液呈碱性,所以乙装置中生成氢氧化钠主要在铁极区,则铁极区的溶液先变红,故答案为:阳极;铁极;
(3)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失电子进入溶液,阴极上析出铜,电极反应式为:Cu2++2e-=Cu;根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小,
故答案为:减小; Cu2++2e-=Cu;
(4)根据串联电池中转移电子数相等得氧气、氢气的关系式为:O2----2H2,设生成氢气的物质的量是xmol,
O2-------2H2
22.4L 2
0.224L x
x=0.02,所以消耗0.02×2=0.04mol氢离子,则乙装置中阳离子交换膜右侧进入左侧的钠离子也为0.04mol,所以乙装置中阳离子交换膜左侧溶液质量将增大0.04×23-0.04×1=0.88g,
故答案为:增大;0.88.
点评 本题以原电池和电解池原理为载体考查了电极反应式的书写、物质的量的有关计算等知识点,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性,燃料相同,如果电解质溶液不同,电极反应式则不同,为易错点.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①可用于分离C2H5OH和CH3COOCH2CH3的混合物 | |
| B. | 装置②可用于收集H2或Cl2等气体 | |
| C. | 装置③可用于吸收HCl或NH3等气体 | |
| D. | 装置④可用于洗涤BaSO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z两元素的简单离子半径Y>Z | |
| B. | X与W可以形成W2X、W2X2两种化合物 | |
| C. | X、Y、Z对应气态氢化物的热稳定性和还原性强弱顺序一致 | |
| D. | Y、Z元素最高价氧化物对应的水化物酸性较强的为H2ZO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Y>Z>X>W | |
| B. | 简单氢化物的稳定性:W<Z<X | |
| C. | Z与W、Y形成的化合物中,其化学键类型不相同 | |
| D. | 最高价氧化物的水化物的酸性:W<Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.8g | B. | 34.2g | C. | 39.2g | D. | 48.3g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
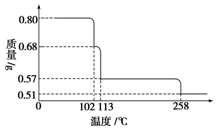 0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.
0.80g CuSO4•5H2O样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 屠呦呦利用乙醇萃取青蒿汁中的青蒿素,获得了2015年度诺贝尔医学奖,为人类防治疟疾作出了重大贡献 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 镁燃烧发出耀眼的白光,常用于制造信号弹和焰火 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com