
| A. | 电子层数多的原子的半径一定大于电子层数少的原子的半径 | |
| B. | P4S3分子中各原子的最外层均已达到了8电子稳定结构,则分子中共价键数目为9条 | |
| C. | H2SO3酸性强于H2CO3,所以非金属性S大于C | |
| D. | 不同原子形成的化合物中一定只含极性键 |
分析 A.同主族从上到下电子层数增多,原子半径增大,不是同主族电子层多半径不一定大;
B.P的最外层有5个电子,形成3个单键可达8电子稳定结构,S的最外层为6个电子,形成2个单键可达到8电子稳定结构,然后根据均摊法计算出P4S3分子中含有的共价键数目;
C.利用最高价含氧酸的酸性比较非金属性;
D.不同原子形成的共价键可能含非极性键.
解答 解:A.同主族从上到下电子层数增多,原子半径增大,则同主族电子层数多的原子半径比电子层数少的大,不是同主族电子层多半径不一定大,如Li的半径大于Cl的半径,故A错误;
B.P4S3分子中没有不饱和键,且各原子的最外层均已达到了8个电子的结构,P原子最外层为5个电子,可形成3个共价键,根据均摊法,每个P原子形成的共价键数目为:$\frac{1}{2}$×3=$\frac{3}{2}$,4个P原子形成的共价键数目为$\frac{3}{2}$×4=6;S原子最外层6个电子,可形成2个共价键,每个S原子可形成的共价键数目为$\frac{1}{2}$×2=1,3个S原子形成的共价键数目为:1×3=3,因此一个三硫化四磷分子中含有的共价键个数为6+3=9个,故B正确;
C.H2SO3酸性强于H2CO3,不能判断非金属性S大于C,因亚硫酸不是最高价含氧酸,故C错误;
D.不同原子形成的化合物中可能含非极性键,如H-O-O-H中含极性键、非极性键,故D错误;
故选B.
点评 本题考查原子结构、元素周期律及化学键等,为高频考点,把握原子结构及电子排布、元素的性质、元素周期律为解答的关键,侧重分析与应用能力的考查,注意周期律的应用,题目难度不大.


 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34g质量分数为4%的H2O2水溶液中含氧原子数目为0.08NA | |
| B. | 反应3H2(g)+N2(g)═2NH3(g)△H=-92kJ/mol,若放出热量4.6kJ,则转移电子数目为0.3NA | |
| C. | 常温常压下,28g乙烯与丙烯的混合气体中含有的碳原子数目无法计算 | |
| D. | 6.4gCu与40mL10mol•L-1浓硝酸作用能生成NO2的分子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
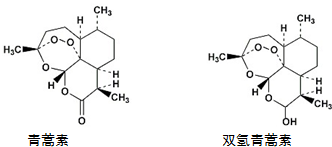
| A. | 青蒿素能发生还原反应 | |
| B. | 双氢青蒿素发生酯化反应和氧化反应 | |
| C. | 青蒿素分子中含有过氧链和酯基、醚键 | |
| D. | 双氢青蒿素分子中有2个六元环和2个七元环 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
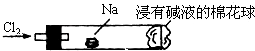 钠与氯气反应的装置如图所示,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,产生大量白烟.则以下叙述错误的是( )
钠与氯气反应的装置如图所示,将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球.先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,产生大量白烟.则以下叙述错误的是( )| A. | 反应生成的大量白烟是氯化钠的细小晶粒 | |
| B. | 玻璃管尾部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气,以免其污染空气 | |
| C. | 钠着火燃烧产生苍白色火焰 | |
| D. | 若在棉花球外侧滴一滴淀粉碘化钾溶液,据其颜色变化判断氯气是否被NaOH溶液完全吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/LNa2CO3溶液中:c(Na+)═(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | pH=l2的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)相等 | |
| C. | 将0.2mol/LNaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)═c(A-)+c(Cl-) | |
| D. | 常温下pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

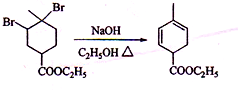 .
.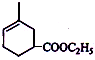 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com