
| A. | 常温下,1L pH=3的硫酸溶液中,SO42-离子的数目约为5×10-4NA | |
| B. | 1mol氨基(NH2)中含有电子的数目为10NA | |
| C. | 一定条件下,1molN2与3molH2充分反应,转移电子的数目可能为2NA | |
| D. | 3molNO2和H2O完全反应,被还原的NO2分子数目为1NA |
分析 A.依据溶液中PH和溶液体积计算得到溶液中的氢离子物质的量,n(H+)=1L×10-3mol/L=0.001mol,硫酸电离方程式计算硫酸根离子物质的量得到离子数目;
B.1个氨基(NH2)中含电子9个;
C.合成氨的反应是可逆反应不能进行彻底;
D.3molNO2和H2O完全反应,3NO2+H2O=2HNO3+NO,氮元素化合价+4价降低为+2价,发生还原反应,被还原生成NO.
解答 解:A.常温下,1L pH=3的硫酸溶液中,n(H+)=1L×10-3mol/L=0.001mol,H2SO4=2H++SO42-,SO42-离子的数目约为5×10-4NA,故A正确;
B.1个氨基(NH2)中含电子9个,1mol氨基(NH2)中含有电子的数目为9NA ,故B错误;
C.在密闭容器中,1molN2与3molH2在一定条件下充分反应,反应是可逆反应,不能进行完全,若1mol氮气全部反应电子转移为6mol,所以转移电子的数目可能为2NA,故C正确;
D.3molNO2和H2O完全反应,3NO2+H2O=2HNO3+NO,氮元素化合价+4价降低为+2价,发生还原反应,被还原生成NO,所以被还原的NO2分子数目为1NA,故D正确;
故选B.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是微粒数和物质的量的计算,氧化还原反应电子转移计算,可逆反应不能进行彻底,题目难度中等.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
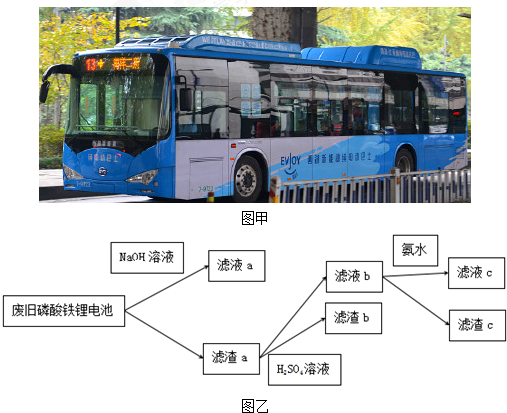
| A. | 向滤液a中加入适量H2SO4溶液,可以得到白色沉淀 | |
| B. | 滤液b中加入氨水的目的是使Fe3+沉淀,滤渣c为红褐色 | |
| C. | 要将Li从溶液中析出,可在滤液c中加入足量Na2CO3溶液,加热浓缩,冷却结晶 | |
| D. | 图中的氨水可以用适量NaOH溶液代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
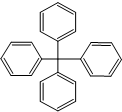 的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )
的4个氢原子全部被苯基取代,可得如图所示的分子,对该分子的描述不正确的是( )| A. | 分子式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 是共价化合物 | D. | 是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 步驟序号 | 操作步骤 | 现 象 |
| (1) | 用pH试纸检验 | 溶液的pH>7 |
| (2) | 向溶液中滴加氯水,再加人CC14、振荡、静置 | 下层呈橙色 |
| (3) | 向(2)所得水溶液中加人Ba(N03)2溶液和 稀 HNO3 | 有白色沉淀产生 |
| (4) | 过滤,向滤液中加人AgNO3溶液和稀HNO, | 有白色沉淀产生 |
| A. | 不能确定的离子是① | B. | 不能确定的离子是②③ | ||
| C. | 肯定含有的离子是①④⑥ | D. | 肯定没有的离子是②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
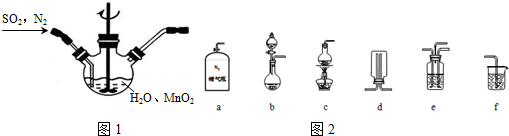
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用热的碱水清除炊具上残留的油污比冷的碱水清除效果好 | |
| B. | 面粉和炒菜用的花生油的主要成分均为天然高分子化合物 | |
| C. | 炒菜用过的铁锅,经放置常出现红棕色斑迹,主要发生的是电化学腐蚀 | |
| D. | 早餐经常食用的豆浆和牛奶均属于胶体,且均含有丰富的蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的0℃冰与0℃的水内能相同 | B. | 冰和可燃冰都是结晶水合物 | ||
| C. | 冰和干冰、水晶的空间结构相似 | D. | 氢键影响冰晶体的体积大小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com