

分析 (1)本题实验原理是向混合物中加酸产生二氧化碳和二氧化硫气体,用高锰酸钾溶液除去二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,接着将气体通过浓硫酸干燥,最后用碱石灰吸收二氧化碳气体,碱石灰增加的质量即为二氧化碳气体的质量;
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置;
(3)高锰酸钾溶液的作用是吸收二氧化硫气体;
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,将被碱石灰吸收,所以碱石灰质量将偏大,再根据实验原理分析;
(5)碱石灰增重(b-a)g,二氧化碳物质的量为$\frac{b-a}{44}$mol,由碳元素守恒,碳酸氢钠物质的量也为$\frac{b-a}{44}$mol,碳酸氢钠质量为$\frac{84(b-a)}{44}$g,
最后求出混合物中NaHCO3的质量分数;
(6)碱石灰能吸收空气中的二氧化碳和水蒸气.
解答 解:(1)本题实验原理是向混合物中加酸产生二氧化碳和二氧化硫气体,用高锰酸钾溶液除去二氧化硫,然后通过品红溶液检验二氧化硫是否除尽,接着将气体通过浓硫酸干燥,最后用碱石灰吸收二氧化碳气体,碱石灰增加的质量即为二氧化碳气体的质量.所以装置连接顺序是aihdefgbc,故答案为:i h d e b c;
(2)实验开始,混合物加酸前,A装置需要鼓入空气目的是排出系统中的二氧化碳气体,加酸后再次鼓入空气的作用是使生成的气体全部进入后续装置.故答案为:排出装置中原有空气;将生成的气体全部送入后续装置;
(3)高锰酸钾溶液的作用是吸收二氧化硫气体,故答案为:吸收二氧化硫气体;
(4)若品红溶液褪色,说明二氧化硫气体没有除尽,将被碱石灰吸收,所以碱石灰质量将偏大,根据实验原理分析可知二氧化碳气体的质量偏大,则混合物中NaHCO3偏大,测定结果将偏高.故答案为:高;
(5)碱石灰增重(b-a)g,二氧化碳物质的量为$\frac{b-a}{44}$mol,由碳元素守恒,碳酸氢钠物质的量也为$\frac{b-a}{44}$mol,碳酸氢钠质量为$\frac{84(b-a)}{44}$g,
NaHCO3的质量分数为:$\frac{\frac{84(b-a)}{44}}{m}×100%$=$\frac{21(b-a)}{11m}×100%$,故答案为:$\frac{21(b-a)}{11m}×100%$;
(6)碱石灰与大气相通,碱石灰能吸收空气中的二氧化碳和水蒸气,所以应在碱石灰后面再连接一个装有碱石灰的装置.故答案为:在B之后再接一个阻止空气中水和二氧化碳进入B的装置.
点评 本题主要目的是测定二氧化碳气体的质量,但二氧化硫也能被碱石灰吸收,所以在吸收二氧化碳气体前应将二氧化硫气体除尽,除去二氧化硫气体一般用酸性高锰酸钾溶液或溴水,再用品红溶液检验二氧化硫气体是否除尽.


科目:高中化学 来源: 题型:解答题
 在一烧杯中盛有28.5g NaHCO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总量与所滴入盐酸的质量关系曲线如图所示,请根据题意回答问题:
在一烧杯中盛有28.5g NaHCO3和NaCl组成的固体混合物.向其中逐渐滴加溶质质量分数为10%的稀盐酸.放出气体的总量与所滴入盐酸的质量关系曲线如图所示,请根据题意回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数为78 | B. | 中子数为53 | C. | 质量数为131 | D. | 核外电子数为78 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | H+H→H-H | |
| B. | 2NH4Cl+Ba(OH)2•8H2O═BaCl2+2NH3↑+10H2O | |
| C. | Mg+2HCl═MgCl2+H2↑ | |
| D. | H2SO4+2KOH═K2SO4+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| A | CH3CH3+Cl2 $\stackrel{光照}{→}$CH3CH2Cl+HCl CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
| B | 由油脂得到甘油 由淀粉得到葡萄糖 | 均发生了水解反应 |
| C | Cl2+2Br?═2Cl?+Br2 Zn+Cu2+═Zn2++Cu | 均为单质被还原的置换反应 |
| D | 2Na2O2+2H2O═4NaOH+O2↑ Cl2+H2O?HCl+HClO | 均为水作还原剂的氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +2CH3COOH$→_{△}^{浓硫酸}$
+2CH3COOH$→_{△}^{浓硫酸}$ +2H2O.
+2H2O. ,
, ,
, .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
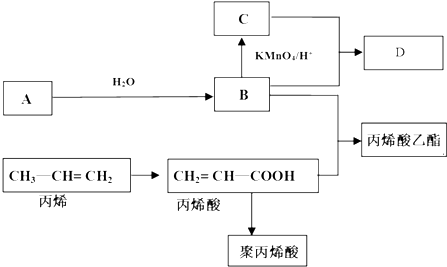
 CH2=CH-COOC2H5+H2O反应类型:酯化反应或取代反应
CH2=CH-COOC2H5+H2O反应类型:酯化反应或取代反应查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ NH4+ HCO3- OH- | B. | Fe2+ H+ NO3- SO42- | ||
| C. | Na+ Cu2+ SO42- NO3- | D. | Al3+ Ba2+ CO32- Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com